微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知氢有3种核素: ,氯有2种核素:
,氯有2种核素: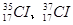 ,则HCl分子的相对分子质量数值可能有几种
,则HCl分子的相对分子质量数值可能有几种
A.1种
B.5种
C.6种
D.1000种
参考答案:B
本题解析:根据排列组合可知,HCl的相对分子质量的数值可以是36、37、38、39、40,答案选B。
本题难度:一般
2、填空题 (15分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空:
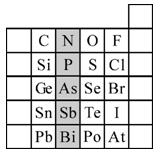
(1)所示元素中
①非金属性最强的元素是:?
②金属性最强的元素是:?
③原子半径最小的是:?
④最高价含氧酸酸性最强的是?
⑤经常用作半导体材料的元素是:?(只写一种)
⑥阴影部分属于元素周期表中的?族,该族元素的最高正价均为?
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 ?H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S?HCl
③沸点:HF?HCl
④还原性:I-?Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:?
A.O和F? B.F和S? C.S和Cl? D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:?
A.?常温下Se单质是气体
B.?Se最高价氧化物的水化物能和NaOH发生反应
C.?氢化物的化学式为H2Se
D.?常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
参考答案:(反应方程式2分,其余每空1分,共15分)
(1)① F?② Pb?③ F?④ HClO4?⑤Si 或Ge (任一种即可)?⑥ⅤA? +5
(2)①H3AsO4 ?<?H3PO4;?②H2S? <?HCl?③HF? >?HCl
④I- ?>?Br-?⑤ D
(3)① BC?②Br2+2H2O+SO2==4H+?+?SO42-+2Br-
本题解析:略
本题难度:简单
3、选择题 X元素原子的质量数为m,核内中子数为n,则Wg X2+ 离子含有的电子的物质的量约为( )
A.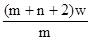 mol
mol
B.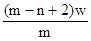 mol
mol
C.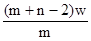 mol
mol
D.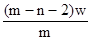 mol
mol
参考答案:D
本题解析:X元素的原子序数是m-n,则X2+ 离子的电子数是m-n-2。所以Wg X2+ 离子含有的电子的物质的量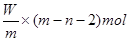 ,所以答案是D。
,所以答案是D。
本题难度:一般
4、选择题 “稀土”是我国宝贵的战略资源,国家即将控制其出口。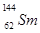 与
与 是稀土元素,下列有关说法不正确的是
是稀土元素,下列有关说法不正确的是
A.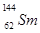 与
与 互为同位素
互为同位素
B.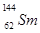 在元素周期表中位于第三周期第ⅢB族
在元素周期表中位于第三周期第ⅢB族
C.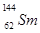 与
与 是不同的核素
是不同的核素
D.据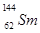 与
与 的质量数可以确定Sm元素的相对原子质量为147
的质量数可以确定Sm元素的相对原子质量为147
参考答案:BD
本题解析:考查原子结构等概念
B.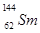 在元素周期表中位于第六周期第ⅢB族,错误
在元素周期表中位于第六周期第ⅢB族,错误
D项中元素相对原子质量应由各核素的相对原子质量与其丰度的乘积和来计算,错误
答案为BD
本题难度:简单
5、填空题 (9分)A、X、Y、Z和W是原子序数依次增大的五种短周期元素。A和X可组成两种常温下为液态的化合物A2X、A2X2,X和Y也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色。在元素周期表中,A与Y同主族,X与Z同主族,Z与W相邻。请同答:
(1)A2X2的结构式?,Y2X2的电子式?。
(2)X、Z两种元素的氢化物中熔沸点较高的是?(填化学式,下同);工业上将Z的低价氧化物转化为高价氧化物的化学方程式为?。
(3)W元素在周期表中的位置为?;实验室制备W单质的化学反应方程式为?;在上述反应中氧化剂和还原剂的物质的量比为?。
参考答案:(1)H-O-O-H;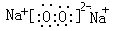
(2)H2O? 2SO2+O2 2SO3
2SO3
(3)第三周期第VIIA族? 4HCl(浓)+MnO2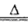 2H2O + Cl2↑+MnCl2;1:2
2H2O + Cl2↑+MnCl2;1:2
本题解析:(1)A和X可组成两种常温下为液态的化合物A2X、A2X2,可判断A是H元素,X是O元素;O与Na也可组成两种常温下为固态的化合物Y2X、Y2X2,且Y2X、Y2X2的焰色反应均为黄色,所以Y是Na;则Z是S元素,W是Cl元素。
(1)A2X2的结构式即过氧化氢的结构式,过氧化氢是共价化合物,其结构式为H-O-O-H;Y2X2是过氧化钠,过氧化钠是离子化合物,电子式为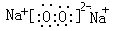 ;
;
(2)O与S的氢化物中,H2O的沸点较高,因为水分子间存在氢键;Z的低价氧化物是二氧化硫,转化为高价氧化物是三氧化硫,化学方程式为2SO2+O2 2SO3
2SO3
(3)Cl在元素周期表中的位置是第三周期第VIIA族;实验室用浓盐酸与二氧化锰加热制取氯气,化学方程式为4HCl(浓)+MnO2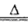 2H2O + Cl2↑+MnCl2;HCl中有1/2作还原剂,二氧化锰作氧化剂,所以该反应中氧化剂与还原剂的物质的量之比是1:2。
2H2O + Cl2↑+MnCl2;HCl中有1/2作还原剂,二氧化锰作氧化剂,所以该反应中氧化剂与还原剂的物质的量之比是1:2。
本题难度:一般