微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
(1)上述反应的催化剂含有Cu、Zn、Al等元素.写出基态Zn原子的核外电子排布式______.
(2)根据等电子原理,写出CO分子结构式______.
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反来源:91 考试网应生成Cu2O沉淀.
①甲醇的沸点比甲醛的高,其主要原因是______;甲醛分子中碳原子轨道的杂化类型为______.
②甲醛分子的空间构型是______;1mol甲醛分子中σ键的数目为______.
③在1个Cu2O晶胞中(结构如图1所示),所包含的Cu原子数目为______.
(4)元素Cu的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物HnCuCl3,反应的化学方程式为______.
参考答案:(1)Zn的原子序数为30,注意3d轨道写在4s轨道的前面,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,
故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;
(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:N≡N,互为等电子体分子的结构相似,可写出CO的结构式为C≡O,故答案为:C≡O;
(3)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高,甲醛分子中含有碳氧双键,故碳原子轨道的杂化类型为sp2杂化,故答案为:甲醇分子之间形成氢键;sp2杂化;
?②甲醛为sp2杂化,不含孤电子对,分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳氢δ键,1mol碳氧δ键,故含有δ键的物质的量为3mol,数目为3NA个;
故答案为:平面三角形;3NA;
③依据晶胞示意图可以看出Cu原子处于晶胞内部,所包含的Cu原子数目为4,故答案为:4;
(4)由晶胞可知Cu原子位于晶胞内部,含有4个Cu,Cl位于顶点和面心,共含有8×18+6×12=4,则氯化物的化学式是CuCl,它可与浓盐酸发生非氧化还原反应,生成配合物HnCuCl3,则应需要2HCl,
则反应的化学方程式为CuCl+2HCl=H2CuCl3.
故答案为:CuCl;CuCl+2HCl=H2CuCl3.
本题解析:
本题难度:一般
2、选择题 p能级最多可容纳的电子数为( )
A.10
B.6
C.3
D.1
参考答案:P能级有3个轨道,根据泡利不相容原理可知每个轨道可容纳2个自旋方向不同的电子,则共6个,
故选B.
本题解析:
本题难度:一般
3、填空题 请根据构造原理,写出下列元素基态原子的电子排布式:
(1)C ___________________。
(2)Ne__________________ 。
(3)S ___________________。
(4)32Ge________________ 。
参考答案:(1)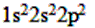
(2)
(3)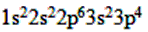
(4)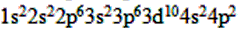
本题解析:
本题难度:一般
4、选择题 某主族元素的原子的最外层电子数是次外层的a倍(a>1),则该原子核内质子数是( )
A.2a
B.a+2
C.2a+10
D.2a+2
参考答案:D
本题解析:
本题难度:简单
5、简答题 下列有关物质结构的表述正确的是( )
A.次氯酸的电子式

B.二氧化硅的分子式SiO2
C.硫原子的最外层电子排布式3s23p4
D.钠离子的结构示意图

参考答案:A、次氯酸的电子式为:

,A错;
B、二氧化硅是原子晶体,其结构中不存在分子,B错;
C、S是16号元素,其核外电子排布为:1s22s22p63s23p4,最外层电子排布式3s23p4,C对;
D、钠离子是钠原子失去了最外层的1个电子,其原子结构示意图为:
,D错.
故选:C.
本题解析:
本题难度:一般