|
高中化学知识点总结《化学平衡常数》试题巩固(2017年最新版)(十)
2017-08-26 01:37:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应聊mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数在φ(C)在不同温度(T)和不同压强(p)的条件下随时间变化如图所示.下列叙述正确的是( )
A.达到平衡后,若使用催化荆,C的体积分数将增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中n<e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
| 
参考答案:BC
本题解析:
本题难度:简单
2、简答题 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)?CO2(g)十H2?(g),CO和H2O浓度变化如图,
| 时间(min) | CO | H2O | CO2 | H2
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
C1
C2
C3
C3
4
C1
C2
C3
C3
5
0.116
0.216
0.084
6
0.096
0.266
0.104
|
(1)该反应的平衡常数表达式为K=______;
(2)已知上述反应为放热反应,则其反应热△H______零(填“大于”、“小于”或“等于”);?升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min-4min之间反应处于______状态;?C1数值______0.08mol/L?(填大于、小于或等于).
②反应在4min-5min间,平衡向逆反应方向移动,可能的原因是______(单选),表中5min-6min之间数值发生变化,可能的原因是______(单选).
a.增加水蒸气?b.降低温度
c.使用催化剂?d.增加氢气浓度.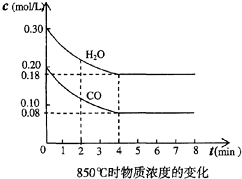
参考答案:(1)可逆反应CO(g)十H2O(g)?CO2(g)十H2?(g)的平衡常数k=c(CO2)?c(H2)c(CO)?c(H2O),
故答案为:c(CO2)?c(H2)c(CO)?c(H2O);
(2)放热反应的△H<0,该反应正反应是放热反应,升高温度平衡向逆反应移动,故平衡常数减小,
故答案为:小于,减小;
(3)①由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态,
该反应正反应是放热反应,升高温度平衡向逆反应移动,故该温度下平衡时CO的浓度比原平衡850℃大,
故答案为:平衡,大于;
②反应中△c(CO)=△c(H2O)=△c(CO2)=△c(H2),由表中数据可知,5min时与开始相比CO、H2O、CO2的浓度变化之比为1:1:1,平衡向逆反应移动,故可能升高温度、降低压强或增大氢气的浓度,故选d;
表中5min-6min之间,CO浓度降低0.02mol/L、H2O的浓度增大0.05mol/L、CO2的浓度增大0.02mol/L,故应该是增大水蒸气的浓度,故选a,
故答案为:d,a.
本题解析:
本题难度:一般
3、填空题 以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下:

回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为___。在(NH4)2SO4溶液中,存在NH4+ +H2O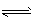 NH3·H2O+H+,该反应的平衡常数表达式为K=___ 。 NH3·H2O+H+,该反应的平衡常数表达式为K=___ 。
(2)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为___。
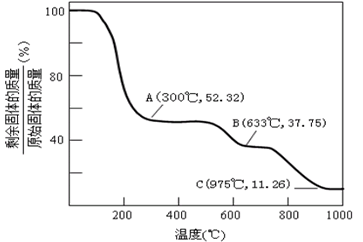
(3)固体NH4Al(SO4)2.12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体成分的化学式为___ 。
(4)综上分析,流程图中M的主要成分的化学式为___,M可用一种物质吸收以实现循环利用,该物质的名称是___。
参考答案:(1)2Fe2+ +H2O2+2H+=2Fe3+ +2H2O;
(2)NH4Al(SO4)2+5NaOH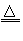 NH3↑+3H2O+NaAlO2+ 2Na2SO4 NH3↑+3H2O+NaAlO2+ 2Na2SO4
(3) Al2(SO4)3
(4)NHa、H2O、SO3?; 浓硫酸或水
本题解析:
本题难度:一般
4、填空题 哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a?mol?CO2和a?mol?H2,测得不同时刻的c(H2)如右表.
| 时间/min | C(H2)/mol.L-1
0
0.40
2
0.28
4
0.19
6
0.13
8
0.08
10
0.04
12
0.04
|
(1)写出生成CH3OH反应的化学方程式:______.若达平衡状态时,放出的热量为58.8kJ,则上述反应的△H=______.0~10min内,CH3OH的平均反应速率v(CH3OH)=______.
(2)下列措施能使平衡体系中增大的是______(填字母).
A、升高温度?B、充入Ar使压强增大
C、再充入0.5a?mol?CO2和0.5a?mol?H2D、将水从平衡体系中分离出来
(3)a=______,该温度下上述反应的平衡常数K=______(精确到0.1).
(4)在如图所示的坐标系中,画出CO2和H2的浓度随时间变化的图象.
参考答案:(1)CO2(g)与H2(g)反应生成CH3OH(g)和H2O(g).由表中数据可知10min起氢气的浓度不再变化,且不为0,所以为可逆反应.反应方程式为CO2+3H2
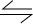
CH3OH+H2O.
由表中数据可知氢气的起始浓度为0.40mol/L,平衡浓度为0.04mol/L,所以参加反应的氢气的物质的量为
(0.40mol/L-0.04mol/L)×10L=3.6mol,所以3mol氢气反应放出的热量为3mol3.6mol×58.8kJ=49kJ,所以则上述反应的CO2+3H2

CH3OH+H2O的反应热△H=-49kJ/mol.
由表中数据可知10min内△c(H2)=0.40mol/L-0.04mol/L=0.36mol/L,所以v(H2)=0.36mol/L10min=0.036mol/(L?min).
速率之比等于化学计量数之比,所以v(CH3OH)=13v(H2)=13×0.036mol/(L?min)=0.012mol/(L?min),
故答案为:CO2+3H2

CH3OH+H2O;-49kJ/mol;0.012mol/(L?min);
(2)A、该反应为放热反应,升高温度,平衡向逆反应方向移动,c(CH3OH)减小,c(CO2)增大,所以c(CH3OH)c(CO2)减小,故A错误;
B、充入Ar使压强增大,体积不变,反应混合气体浓度不变,平衡不移动.所以c(CH3OH)c(CO2)不变,故B错误;
C、等效为开始充入1.5a?mol?CO2和1.5a?mol?H2,体积变为原来1.5倍,平衡后再将体积压缩为原来体积.增大压强平衡向体积减小的方向移动,即向正反应移动,c(CH3OH)增大,c(CO2)减小,所以c(CH3OH)c(CO2)增大,故C正确;
D、将水从平衡体系中分离出来,生成物的浓度降低,平衡向正反应移动.c(CH3OH)增大,c(CO2)减小,所以c(CH3OH)c(CO2)增大,故D正确.
故选:CD;
(3)由表中数据可知氢气的起始浓度为0.40mol/L,所以a=0.40mol/L×10L=4mol.
根据三段式求出各组分的浓度变化量、平衡时各组分的浓度,
由表中数据可知氢气的起始浓度为0.40mol/L,所以二氧化碳的起始浓度也为0.40mol/L,平衡时氢气浓度为0.04mol/L,
?对于反应? CO2(g)+3H2(g)

CH3OH(g)+H2O(g)
开始(mol/L):0.4? 0.4? 0? 0
变化(mol/L):0.12?0.4-0.04=0.36? 0.12? 0.12
平衡(mol/L):0.28?0.04? 0.12? 0.12
所以平衡常数k=c(CH3OH)?c(H2O)c(CO2)?c3(H2)=0.12×0.120.28×0.043=803.6,
故答案为:4mol;803.6;
(4)由(3)计算可知,二氧化碳、氢气的起始浓度为0.40mol/L.氢气的平衡浓度为0.04mol/L,二氧化碳的平衡浓度为0.28mol/L.
由方程式 CO2(g)+3H2(g)

CH3OH(g)+H2O(g)可知,相同时间内H2的浓度变化是CO2浓度变化的3倍,再根据表中氢气各时刻的浓度,计算二氧化碳的各时刻浓度.
作图如图所示:

,故答案为:

.
本题解析:
本题难度:一般
5、填空题 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
(1)该反应的化学方程式为______.
(2)反应开始至2min,以气体Z表示的平均反应速率为______.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:①此时体系的压强是开始时的______倍;②达平衡时,容器内混合气体的平均相对分子质量比起始投料时______(填“增大”“减小”或“相等”).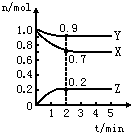
参考答案:(1)、由图象可以看出,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,2min后,X、Y的物质的量为定值且不为零,为可逆反应,相同时间内物质的量的变化比值为:△n(X):△n(Y):△n(Z)=(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,则化学方程式为3X+Y?

?2Z,
故答案为:3X+Y?

?2Z;
(2)、反应开始至2min,气体Z的平均反应速率为v=0.2mol2L2min=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
(3)、①反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,
起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,
反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=9:10,此时体系的压强是开始时的 0.9倍
故答案为:0.9.
②平衡时,混合气体的平均摩尔质量为.M=m总n总,气体的总质量不变,总物质的量减少,混合气体的平均摩尔质量增大,
故答案为:增大
本题解析:
本题难度:一般
| 

