微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
参考答案:D
本题解析:
本题难度:一般
2、简答题 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如表所示:
请回答下列问题:
(1)上述反应的化学平衡常数表达式为:______,该反应的Q______0.
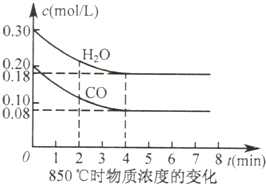
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率v(CO)=______.
(3)若在500℃时进行,且CO、H2O(g)的超始浓度均为0.020mol/L,该条件下,CO的最大转化率为______.
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为______.
(5)某电化学装置可实现2CO2═2CO+O2的转化,使CO重复使用.已知该反应的阳极反应为4OH--4e-═2H2O+O2,则阴极反应式为______.
(6)有人提出可以设计反应2CO═2C+O2(△H>0)来消除CO的污染,请判断上述反应能否发生______(填“可能”或“不可能”),理由是______.
参考答案:(1)CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为:K=;由表中数据可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动,故正反应为放热反应,△H=Q<0,
故答案为:K=c(CO2)?c(H2)c(CO)?c(H2O);<;
(2)v(CO)=0.20mol/L-0.08mol/L4min=0.03mol/(L?min),
故答案为:0.03mol/(L?min);
(3)设CO的浓度变化量为c,则
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol/L):0.020.020 0
转化(mol/L):cc c c
平衡(mol/L):0.02-c 0.02-ccc
代入500℃时反应平衡常数有k=c(CO2)?c(H2)c(CO)?c(H2O)=c×c(0.02-c)×(0.02-c)=9,解得c=0.015,
CO的最大所以转化率为:0.0150.2×100%=75%,
故答案为:75%;
(4)因800℃时反应平衡常数为1.起始时水的物质的量为xmol,CO的物质的量为 (1-x)mol,则
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol/L):(1-x)x00
转化(mol/L):(1-x)y(1-x)y(1-x)y(1-x)y
平衡(mol/L):(1-x)(1-y)(x-y+xy)(1-x)y(1-x)y
所以平衡常数k=(1-x)y×(1-x)y(1-x)(1-y)×(x-y+xy)=1,解得y=x,
故答案为:y=x;
(5)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-;
(6)反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行,
故答案为:不能;该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
本题解析:
本题难度:一般
3、选择题
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,NO2和N2O4浓度随时间变化关系如图.下列说法不正确的是( )
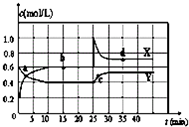
A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线
B.前10min内用v(N2O4)表示的化学反应速率为0.2mol/(L?min)
C.25min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L
D.前10min内用v(NO2)表示的化学反应速率为0.04mol/(L?min)