|
高中化学知识点大全《气体的净化、干燥、吸收与收集》高频考点强化练习(2017年最新版)(十)
2017-08-26 01:44:47
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 实验室制取下列气体时,应选用下列哪种酸:(填入相应的字母。)
A.浓盐酸
B.稀盐酸
C.稀硫酸
D.浓硫酸
| ⑴用大理石和??制CO2 ;?⑵用MnO2和?制Cl2;
⑶用锌粒和??制H2 ;?⑷用食盐和??制HCl。
参考答案:(1) B? (2) A? (3) B或C? (4) D
本题解析:略
本题难度:简单
2、实验题 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
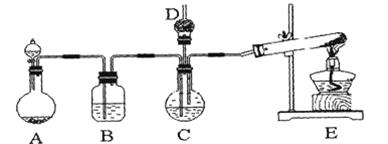
(1)A中制备气体时,所需药品是(选填字母序号)?;
(2)B中盛有饱和碳酸氢钠溶液,其作用是?;
(3)写出制取氨气的化学方程式?;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式?;
(5)检验D出口处是否有氨气逸出的方法是?;
(6)写出制纳米级碳酸钙的化学方程式?。
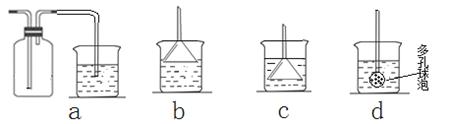
(7)若实验过程中有氨气逸出,应选用下列?装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
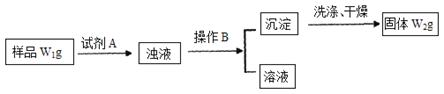
试回答:
(1)所加试剂A的化学式为?
(2)B操作方法是?
(3)样品中氯化铵的质量分数为?。
参考答案:Ⅰ.(1)ac(1分)(2)除去CO2中的HCl(1分)?
(3)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O?(4)NH3(1分) CaCl2 + 2NH3↑+ 2H2O?(4)NH3(1分)
(5)将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。)(2分)
(6)CaCl2 + H2O + CO2 + 2NH3 = CaCO3 + 2NH4Cl(2分)
(7)b(1分)
Ⅱ.(1)Ca(OH)2或Ba(OH)2或AgNO3和HNO3(1分)?
(2)过滤(1分)
(3)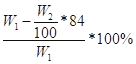 或 或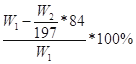 或53.5W2/143.5W1×100% 或53.5W2/143.5W1×100%
本题解析:Ⅰ.(1)分析题意知,装置A为碳酸钙与盐酸反应制二氧化碳,所需药品是石灰石和6mol/L盐酸,答案为:ac;(2)饱和NaHCO3溶液可除去二氧化碳中的氯化氢;(3)实验室制取氨气采用氯化铵和氢氧化钙加热,生成氯化钙、氨气和水,方程式为:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O;(4)氨气极易溶于水,先通入氨气利于二氧化碳的吸收,所以应先通入NH3;(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,答案为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。);(6)制纳米级碳酸钙的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;(7)氨气极易溶于水要防止倒吸,答案为:b; CaCl2 + 2NH3↑+ 2H2O;(4)氨气极易溶于水,先通入氨气利于二氧化碳的吸收,所以应先通入NH3;(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,答案为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。);(6)制纳米级碳酸钙的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;(7)氨气极易溶于水要防止倒吸,答案为:b;
Ⅱ.(1)根据题目信息可知:碳酸氢钠能与氢氧化钡或氢氧化钙反应生成碳酸钡或碳酸钙沉淀,根据沉淀的质量求出碳酸氢钠的质量,最后求出氯化铵的质量以及质量分数;氯化铵能与硝酸酸化的硝酸银反应生成氯化银沉淀,根据沉淀的质量求出氯化铵的质量,最后求出氯化铵的质量分数;所以A为Ca(OH)2或Ba(OH)2或AgNO3和HNO3;(2)操作B为不溶物和溶液分离操作,用过滤的方法;(3)若试剂为Ca(OH)2溶液,根据碳守恒得关系式:NaHCO3——CaCO3,计算得NaHCO3的质量为84W2/100g,则氯化铵的质量为(W1—84W2/100)g,氯化铵的质量分数为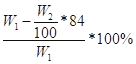 ,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为 ,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为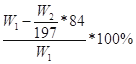 ,若试剂为AgNO3和HNO3,由关系式NH4Cl——AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。 ,若试剂为AgNO3和HNO3,由关系式NH4Cl——AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。
本题难度:一般
3、实验题 (16分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
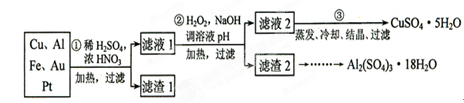
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是?
?;调溶液pH的目的是使?生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是?。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
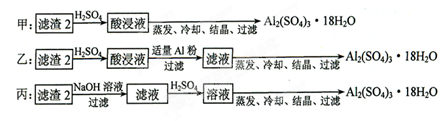
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用cmol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶?
b.滴定终点时滴定管尖嘴中产生气泡?
c.未除净可与EDTA反应的干扰离子
参考答案:(1)Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O? Au? Pt 3Cu2++2NO↑+4H2O? Au? Pt
(2)将Fe2+氧化为Fe3+不引入杂质,对环境无污染? Fe3+?Al3+
(3)加热脱水
(4)甲?所得产品中含有较多Fe2(SO4)3杂质?乙
(5) ? c ? c
本题解析:(1)稀硫酸和铜不反应,所以硝酸才能溶解铜,方程式为Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;由于浓硝酸也不能溶解金和Pt,所以滤渣1的主要成分为Au和Pt。 3Cu2++2NO↑+4H2O;由于浓硝酸也不能溶解金和Pt,所以滤渣1的主要成分为Au和Pt。
(2)由于滤液中I中含有亚铁离子,必须除去,而双氧水能氧化亚铁离子生成铁离子,然后沉淀生成氢氧化铁而除去;双氧水的还原产物是水,不引入杂质,对环境无污染;可知pH的目的是除去溶液中的铁离子和铝离子,以得到纯净的硫酸铜晶体。
(3)胆矾通过加热脱水即生成硫酸铜。
(4)由于滤渣Ⅱ中含有氢氧化铁,所以甲方案中会产生硫酸铁,即最终所得产品中含有较多Fe2(SO4)3杂质,所以甲方案是不正确的;丙方案中有硫酸钠生成,所以原子利用率不如乙方案。
(5)根据方程式可知,20ml溶液中铜离子的物质的量是0.001bcmol,所以CuSO4·5H2O质量分数的表达式w=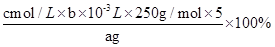 ;锥形瓶不需要干燥,a不影响;滴定终点时滴定管尖嘴中产生气泡,说明消耗的标准液体积偏小,则测定结果偏低;未除净可与EDTA反应的干扰离子,则消耗的标准液体积偏大,测定结果偏高,答案选c。 ;锥形瓶不需要干燥,a不影响;滴定终点时滴定管尖嘴中产生气泡,说明消耗的标准液体积偏小,则测定结果偏低;未除净可与EDTA反应的干扰离子,则消耗的标准液体积偏大,测定结果偏高,答案选c。
本题难度:一般
4、实验题 某课外活动小组用如图所示装置制取次氯酸钠。图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸。
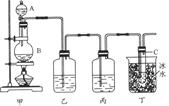
完成下列问题:
(1)烧瓶B中盛____________,大试管C中盛____________。
(2)C中发生反应的化学方程式________________________________________________?。
(3)有同学认为可以省去某些装置,你认为怎样?
①能否省去乙装置_________(答“能”或“不能”),理由是_____________________________。
参考答案:②能否省去丙装置__________(答“能”或“不能”),理由是___________________________。(1)MnO2? NaOH溶液
(2)2NaOH+Cl2====NaCl+NaClO+H2O
(3)①不能? HCl气体进入C中,消耗NaOH,影响尾气的吸收?②能?少量水蒸气进入C中,不影响反应
本题解析:根据氯气的实验装置知,分液漏斗A中盛放的为浓盐酸,烧瓶B中的固体为MnO2,乙装置中盛放饱和NaCl溶液用于吸收挥发出来的盐酸,丙装置中盛放浓硫酸用于干燥氯气,丁装置为尾气吸收装置。
本题难度:简单
5、选择题 用下图实验装置(可添加加热或尾气处理装置)进行以下实验,无法达到目的的是
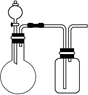
A.实验室制取并收集少量NO2
B.实验室制取并收集少量NH3
C.验证非金属性:C>Si
D.验证氧化性:Cl2>I2
参考答案:B
本题解析:A、用Cu和浓硝酸反应制取NO2,向上排空气收集可得NO2,正确;B、NH3的密度小于空气,集气瓶中进气的导管要短,排出气体的导管应该长,错误;C、用CaCO3与稀盐酸反应制取CO2,然后把CO2通入Na2SiO3溶液,可验证C、Si元素的非金属,正确;D、用KMnO4和浓盐酸制取Cl2,然后把Cl2通入KI溶液,可验证Cl2和I2的氧化性,正确。
本题难度:一般
|