微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)某化学实验小组拟用以下装置由乙醇与浓硫酸共热制备乙烯,且进行乙烯的催化氧化实验。

(1)在A处虚线框内绘出该实验装置图。
(2)制取乙烯的化学方程式为?。
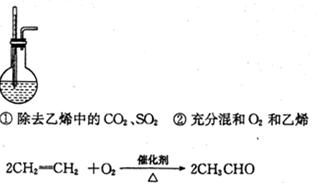
(3)装置B中盛有NaOH溶液,除了便于观察乙烯和氧气的流速以外,还具有的作用是:
①?;②?。
(4)若E中收集到的物质为CH3CHO,则D中发生反应的化学方程式为?。
(5)用乙醇、浓硫酸共热制乙烯,所得乙烯产率较低,原因可能是?(填字母序号)。
A.乙醇部分挥发? B.乙醇部分生成乙醚?
C.乙醇被氧化为C、CO、CO2?D.乙醇消去成乙炔
参考答案:
(5)ABC
本题解析:装置B中盛有NaOH溶液,除了便于观察乙烯和氧气的流速以外,还具有的作用是:除去乙烯中的二氧化碳和二氧化硫,充分混合氧气和乙烯用乙醇、浓硫酸共热制乙烯,所得乙烯产率较低,原因可能是乙醇部分挥发.乙醇部分生成乙醚,乙醇被氧化为C、CO、CO2
本题难度:一般
2、实验题 (14分)现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
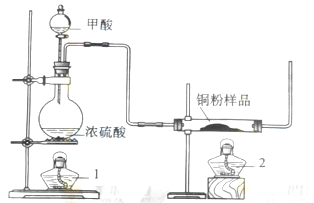 .(1)制备一氧化碳的化学方程式是?;
.(1)制备一氧化碳的化学方程式是?;
(2)实验中,观察到反应管中发生的现象时?;尾气的主要成分是?;
(3)反应完成后,正确的操作顺序为?(填字母)
a.关闭漏斗开关? b.熄灭酒精1? c.熄灭酒精灯2
(4)若实验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为?;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节)? _________________________________________________________;
②写出有关反应的化学方程式?。
参考答案:(14分)
(1)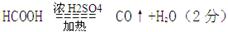
(2)样品粉末逐渐变为红色(2分)? CO、 CO2?(2分)(写对一个给1分)
(3)c a b?(2分)(错任一处不得分)
(4)80%(2分)
(5)①将浓硫酸稀释,称取一定量的样品,样品与过量稀硫酸充分反应,过滤、洗涤、干燥、称量、计算(2分)(用浓硫酸得0分,浓硫酸没稀释,但知道用稀硫酸扣1分,操作正确1分,不写计算也给分)?②CuO+H2SO4=CuSO4+H2O(2分)
本题解析:首先要明确实验目的:制取一氧化碳,测定铜的含量,围绕这一实验目的展开装置、仪器、操作、数据处理等分析。
(1)利用图中所示装置制取CO,并用以测定某铜粉样品中金属铜的含量。装置左边图是制取CO的,反应物为HCOOH和浓硫酸,注意浓硫酸在此做催化剂和脱水剂,HCOOH脱水得到CO;
(2)右边反应管中有黑色CuO和CO反应生成红色的铜单质;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作的原因是防止空气中O2进入右边装置铜又被氧化为氧化铜了;
(4)由氧化铜变为铜产生质量差,可计算铜粉样品5.0g中的铜为4.0g,
则原样品中单质铜的质量分数为4.0÷5.0==80%;
(5)用所给试剂,设计一个测定样品中金属铜质量分数的方案,可用硫酸反应掉氧化铜,过滤称取铜的质量即可。所以操作过程为将浓硫酸稀释,称取一定量的样品,样品与过量稀硫酸充分反应,过滤、洗涤、干燥、称量、计算。
点评:实验题的分析思路:先要明确实验目的,然后再分析实验原理、装置的作用,试剂的选择、数据的处理、现象与数据对结论的关系。
本题难度:一般
3、实验题 (11分)Ⅰ某同学帮助水质检测站配制480 mL 0.5 mol/LNaOH溶液以备使用.
(1)该同学应选择 mL的容量瓶.
(2)其操作步骤如乙图所示,则甲图操作应在乙图中的 (填选项字母)之间.
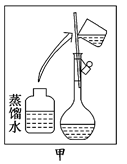
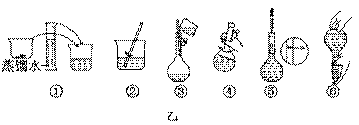
A.②与③ ? B.①与② ? C.④与⑤
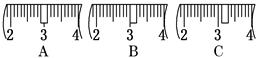
(3)该同学应称取NaOH固体 g,用质量为23.1 g的烧杯放在托盘天平上称取所需 NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母).
NaOH固体时,请在附表中选取所需的砝码大小 (填字母),并在下图中选出能正确表示游码位置的选项 (填字母).
附表 砝码规格
(Ⅱ)如图是医院病人输液时用的一瓶质量分数为5%的葡萄糖注射液标签,请认真观察标签上的所列内容后填写:
(1)该溶液中含水 g.
(2)该溶液的密度为 g/mL.
(3)该溶液的物质的量浓度为 mol/L
参考答案:Ⅰ(1)500 (2)C ?(3)10.0 c、d ? C
Ⅱ(1)237.5 (2)1 (3)
本题解析:略
本题难度:简单
4、简答题 图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置.某学校同学利用中学常用试剂及仪器设计下列实验.
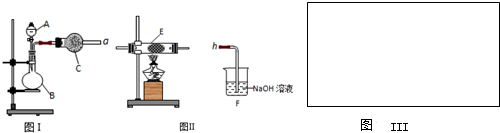
(1)图Ⅰ中仪器B的名称:______.
(2)同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图______.B中发生反应的离子方程式为______.
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量.A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰.该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①______;
②______.
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质.A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器a→b→c→h.
①B内需加入固体试剂的名称为______,B中能产生氨气和氧气混合气体的原因是______.
②实验中观察到E内有红棕色气体出现,证明氨气具有______性,E中发生反应的化学方程式为______.
参考答案:(1)图Ⅰ中仪器B是圆底烧瓶,故答案为:圆底烧瓶;
(2)二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集,如图:
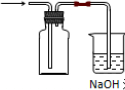
;
铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,故答案为:

;3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(3)CO2中混有的水蒸气也会被C吸收;干燥管与空气相通,空气中的CO2和水蒸气也会被吸收,从而导致实验误差较大,故答案为:CO2中混有的水蒸气也会被C吸收;干燥管与空气相通,空气中的CO2和水蒸气也会被吸收;
(4)①过氧化钠与H2O反应生成氢氧化钠和氧气,同时放出大量热,温度升高使浓氨水中氨的溶解度减小而逸出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;故答案为:过氧化钠;过氧化钠与浓氨水中的H2O反应生成氢氧化钠和氧气,同时放出大量热,温度升高使氨的溶解度减小而逸出,氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;
②氨气中氮元素的化合价是-3价,二氧化氮中氮元素的化合价是+4价,反应前后氮元素的化合价升高,所以氨气作还原剂,体现其还原性;氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮,反应方程式为:4NH3+5O2?催化剂?.加热4NO+6H2O、2NO+O2=2NO2,
故答案为:还原;4NH3+5O2?催化剂?.加热4NO+6H2O、2NO+O2=2NO2.
本题解析:
本题难度:一般
5、实验题 (8分)配制500mL 0.5mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为?。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将?(填“高于”或“低于”)右边的托盘。
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1cm~2cm。
③将NaOH溶液沿玻璃棒注入500mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上顺序编出正 确程序?。
确程序?。
(4)某学生实际配制NaOH溶液的浓度为0.48mol·L-1,不可能的原因是?
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸 馏水
馏水
C.转移溶液后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
参考答案:(1)10.0克?(2)高于
(3)①③④②⑤?(4)B
本题解析:略
本题难度:简单