微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实不能用勒夏特列原理解释的是
A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好
B.配制FeCl3溶液时,在溶液中加入少量稀盐酸
C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快
D.新制的氯水在光照条件下颜色变浅
参考答案:C
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系。A、碳酸钠水解溶液显碱性,可以用去除油污。水解吸热,因此热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好,适用于勒夏特列原理,A不正确;B、铁离子水解溶液显酸性,所以配制FeCl3溶液时,在溶液中加入少量稀盐酸可以抑制铁离子的水解,适用于勒夏特列原理,B不正确;C、固体反应物的接触面积越大,反应速率越快,与勒夏特列原理无关,C正确;D、在氯水中存在平衡Cl2+H2O HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。
HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。
本题难度:一般
2、选择题 在密闭容器中,对于可逆反应A+3B 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

A.若正反应方向ΔH<0,则T1<T2
B.压强增大时,混合气体的平均相对分子质量减小
C.B一定为气体
D.A一定为气体
参考答案:AC
本题解析:如果正反应是放热反应,则升高温度平衡逆反应方向移动,C的体积分数降低,A正确。根据图像可知,随着压强的增大,C的体积分数是增大,说明正反应是体积减小的可逆反应,增大压强平衡向正反应方向移动,所以B一定是气体,C正确。B不正确,压强增大时,混合气体的平均相对分子质量增大。D不正确,物质A不一定是气体。答案选AC。
本题难度:一般
3、选择题 在密闭容器中的一定量混合气体发生反应xA(g)+yB(g) zC(g),平衡时测得A的浓度为0.50mol/L.保持温度不变,将容器的容积扩大到原来的两倍时测得A的浓度降低为0.30mol/L,下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50mol/L.保持温度不变,将容器的容积扩大到原来的两倍时测得A的浓度降低为0.30mol/L,下列有关判断正确的是
A:x+y<z? B:平衡向正方向移动? C:B的转化率降低? D:平衡常数减小
参考答案:C
本题解析:在密闭容器中的一定量混合气体发生反应xA(g)+yB(g) zC(g),平衡时测得A的浓度为0.50mol/L.保持温度不变,将容器的容积扩大到原来的两倍时,在这瞬间,A的浓度为原来的1/2即0.25 mol/L.,当反应达到平衡时A的浓度为0.30mol/L,即平衡向逆反应方向移动,即减少压强,平衡向逆反应方向移动,逆反应方向为气体体积增大的反应,所以
zC(g),平衡时测得A的浓度为0.50mol/L.保持温度不变,将容器的容积扩大到原来的两倍时,在这瞬间,A的浓度为原来的1/2即0.25 mol/L.,当反应达到平衡时A的浓度为0.30mol/L,即平衡向逆反应方向移动,即减少压强,平衡向逆反应方向移动,逆反应方向为气体体积增大的反应,所以
A错,正确为:x+y>z;B错,平衡向逆反应方向移动;C正确;D错,没于反应的温度不变,即平衡常数不变;
本题难度:一般
4、选择题 已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为1mol/(L?·min),则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5 mol/(L ·min)
B.1 mol/(L ·min)
C.2 mol/(L ·min)
D.3 mol/(L ·min)
参考答案:C
本题解析:由于反应速率之比是相应的化学计量数之比,所以根据A的反应速率可知,此段时间内以C的浓度变化表示的化学反应速率为1mol/(L ·min)×2=2 mol/(L ·min),所以正确的答案选C。
本题难度:困难
5、选择题 将一定量的固体Ag2SO4置于容积不变的密闭容器中(装有少量V2O5),某温度下发生反应:
Ag2SO4(s)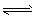 Ag2O(s)+SO3(g),
Ag2O(s)+SO3(g),
2SO3 (g)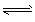 2SO2(g)+O2(g)。
2SO2(g)+O2(g)。
反应经 10min达到平衡,测得c(SO3) =0. 4mol/L,c(SO2) =0.1mol/L。则下列叙述中不正确的是
[? ]
A.容器里气体密度为40g·L-1
B.化学反应速率为v(Ag2SO4) =v(SO3)
C.SO3的分解率为20%
D.在这10min内的平均反应速率v(O2) =0. 005mol/(L·min)
参考答案:B
本题解析:
本题难度:一般