微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数为(?)
A.0.34
B.0.64
C.0.44
D.0.54
参考答案:C
本题解析:氮气和氢气反应的方程式为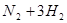 ?
?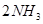 ,相同条件下气体的压强之比=物质的量之比,所以,反应后混合气体的总物质的量为4mol,则
,相同条件下气体的压强之比=物质的量之比,所以,反应后混合气体的总物质的量为4mol,则
由反应方程式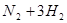 ?
?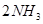 ,设氮气的物质的量变化为xmol,得
,设氮气的物质的量变化为xmol,得
起始物质的量2mol?3mol? 0
变化物质的量? x? 3x? 2x
平衡物质的量 2-x? 3-3x? 2x
解得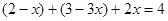 ,
,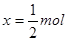 ;所以平衡后
;所以平衡后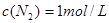 ,
,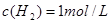 ,
,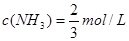 ;
;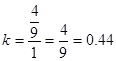
本题难度:一般
2、简答题 工业合成氨的反应为N2+3H2?2NH3.设在容积为2.0L的密闭容器中充入0.6molN2和1.6molH2,反应在一定条件下达到平衡时,NH3的物质的量分数为4/7.计算:
(1)该条件下N2的平衡转化率;(保留到0.1%)
(2)该条件下反应N2+3H2?2NH3的平衡常数.
参考答案:(1)设氮气的转化率是x.
? ?N2+3H2?2NH3
? ?0.6 1.6? 0? 反应前
? 0.6x 1.8x 1.2x? 反应
0.6(1-x)1.6-1.8x 1.2x? ?平衡
平衡时,NH3的物质的量分数=1.2xmol[0.6(1-x)+1.6-1.8x+1.2x]mol=47,
x=66.7%.
故答案为:66.7%.
(2)平衡时氮气的物质的量浓度=0.2mol2.0L=0.1mol/L,氢气的物质的量浓度=0.4mol2.0L=0.2mol/L,氨气的物质的量浓度=0.8mol2.0L=0.4mol/L,
平衡常数K=[C(NH3)]2C(N2).[C(H2)]3=(0.4mol/L)20.1mol/L×(0.2mol/L)3=200.
故答案为:200.
本题解析:
本题难度:一般
3、选择题 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。
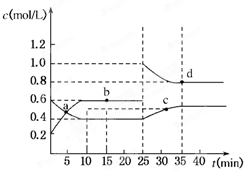
下列推理分析合理的是
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
参考答案:B
本题解析:略
本题难度:一般
4、选择题 某温度下在固定体积的密闭容器中发生如下反应:2M(g)+N(g) 2E(g),若开始时只充入2molE(g),达到平衡时,混合气体的压强比起时增大了20%;若开始时只充入2molM和1molN的混合气体,达到平衡时M的转化率为
2E(g),若开始时只充入2molE(g),达到平衡时,混合气体的压强比起时增大了20%;若开始时只充入2molM和1molN的混合气体,达到平衡时M的转化率为
[? ]
A.20%?
B.40%?
C.60%?
D.80%
参考答案:C
本题解析:
本题难度:一般
5、选择题 (14分)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
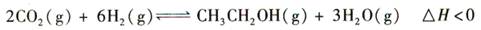
请回答:
(1)该反应的化学平衡常数表达式为?。
(2)当温度T1>T2时,化学平衡常数K1?K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是?(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有?(写出一条合理措施即可)。
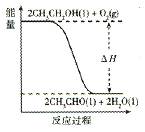
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是?反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为?。
参考答案:(1)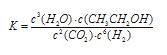
 ?(2)<?(3)b d?
?(2)<?(3)b d?
(4)增大CO2浓度(或增大压强)
(5)放热?反应物总能量大于生成物总能量
(6)CH3CH2OH – 12 e- + 3H2O =2CO2 + 12H+
本题解析:(1)根据化学平衡常数表达式的书写原则,该反应的化学平衡常数表达式见答案;(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,即温度越高,平衡常数越小,温度T1>T2,K1<K2;(3)a.利用正逆反应速率相等作为平衡标志,注意“双向同时,符合比例”,生成1mol?CH3CH2OH的同时,生成3mol?H2O,都表示正反应速率,不能说明到达平衡,错误;b.可逆反应到达平衡时,各组分的物质的量不变,体系中各组份的物质的量浓度不随时间而变化,说明到达平衡,正确;c.反应混合气体的总质量不变,容器的体积不变,密度始终不变,体系中混合气体的密度不随时间而变化,不能说明到达平衡,错误;d.随反应进行混合气体总的物质的量减小,体系中气体的分子总数减少,体系中气体分子总数不随时间而变化,说明到达平衡,正确;选bd;(4)改变条件加快反应速率,同时平衡向正反应移动,可以增大CO2浓度或增大压强,反应速率加快,平衡向正反应移动氢气的转化率增大;(5)由图象可知,反应物的总能量大于生成物的总能量,故该反应物为放热反应;(6)燃料电池负极反应氧化反应,乙醇在负极放电,酸性条件下生成二氧化碳与氢离子,电极反应式为:CH3CH2OH-12?e-+3H2O=2CO2+12H+。
本题难度:一般