微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 Ⅰ.如图所示是分离混合物时常用的仪器,回答下列问题:
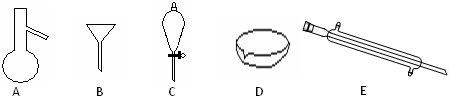
(1)写出仪器A、C、E的名称______
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精:______?汽油和水:______
Ⅱ.实验室用固体烧碱配制200mL?0.5mol?L-1的NaOH溶液.
(1)需称量______?g?烧碱,应放在______中称量、溶解.
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有______
(3)请描述定容操作应采取的具体方法______.
参考答案:Ⅰ(1)图中A是蒸馏烧瓶、C是分液漏斗、E是冷凝管,故答案为:蒸馏烧瓶、分液漏斗、冷凝管;
(2)食用油和酒精,互溶,沸点相差较大,可以采取分馏的方法分离,需要用到的仪器为蒸馏烧瓶、冷凝管等,汽油和水为互不相溶的液体,可以利用分液方法分离,需要的仪器为分液漏斗,
故答案为:AE;C;
Ⅱ(1)没有200mL容量瓶,应选择250mL容量瓶,故需要氢氧化钠的质量为0.25L×0.5mol?L-1×40g/mol=5.0g,
氢氧化钠具有腐蚀性、易潮解,应放在烧杯内,迅速称量、溶解,
故答案为:5.0;烧杯;
(2)配制氢氧化钠溶液需要玻璃仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管等,
故答案为:250mL容量瓶、胶头滴管;
(3)定容操作为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切,
故答案为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切.
本题解析:
本题难度:一般
2、选择题 实验室用浓硫酸配制1 mol·L-1的稀硫酸溶液250 mL,下列不需要的仪器是
[? ]
A.烧杯
B.漏斗
C.玻璃棒
D.容量瓶
参考答案:B
本题解析:
本题难度:简单
3、选择题 配制一定物质的量浓度溶液时,能使所配溶液的浓度偏高的原因是
[? ]
A.没有用水冲洗烧杯2-3次
B.溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切
C.定容时俯视液面使与刻度线相切
D.定容时仰视液面使与刻度线相切
参考答案:C
本题解析:
本题难度:一般
4、实验题 某同学准备用CuSO4·5H2O配制480 mL 1 mol/L的溶液。
⑴该同学选用的容量瓶容积的规格是_________ mL;
⑵玻璃棒在该实验中有重要的用途,分别是_________ 和_________ ;
⑶配制好的溶液呈__________色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。

⑷物质的量浓度误差分析:(填偏高、偏低、无影响)
①若容量瓶洗净后未干燥,残留少量水,则所配制的溶液浓度将__________ ;
②定容时,若眼睛俯视,则所配制的溶液浓度将____________ 。
参考答案:⑴500
⑵ 搅拌,加速固体溶解;引流液体
⑶?蓝色 ;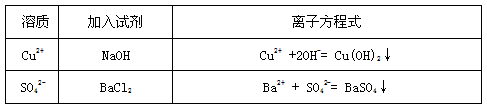
⑷ ① 无影响 ② 偏高
本题解析:
本题难度:一般
5、选择题 将标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g/cm-3,该氨水的物质的量浓度和溶质质量分数分别为
A.18.4mol/L;38.5%
B.18.4mol/L;34.7%
C.20.4mol/L;38.5%
D.20.4mol/L;34.7%
参考答案:B
本题解析:分析:NH3溶于水后虽然大部分生成NH3?H2O,但在计算时,仍以NH3作为氨水中的溶质.气体溶于水后,溶液的体积、密度均发生了改变.
设水的体积为1L,则氨气的体积为700L,由标准状况下的体积可计算氨气的物质的量,溶液质量=氨气质量+水的质量,溶液体积可由溶液的质量和密度来计算.根据质量分数定义、物质的量浓度的定义计算.
解答:NH3溶于水后虽然大部分生成NH3?H2O,但在计算时,仍以NH3作为氨水中的溶质;
设水的体积为1L,氨气的体积为700L,
则氨气的物质的量为=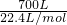 =31.25mol,
=31.25mol,
氨气的质量为31.25mol×17g/mol=531.25g,
溶液的质量为1000g+31.25mol×17g/mol=1531.25g,
溶液的体积为=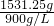 =1.7L,
=1.7L,
则氨水的质量分数为w=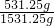 ×100%=34.7%,
×100%=34.7%,
氨水的物质的量浓度为c=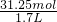 =18.4?mol/L,
=18.4?mol/L,
故选B.
点评:本题考查学生物质的量浓度和质量分数的计算,难度中等,溶液的体积计算是解答本题的关键也是学生解答本题的易错点.
本题难度:困难