微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族
周期
| IA
|
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅧA
|
|
2
|
|
|
| ②
| ③
| ④
|
|
|
3
| ⑤
|
| ⑥
| ⑦
|
| ⑧
| ⑨
|
|
(1)证明⑨的非金属性比⑧强的实验事实是 ;
②的单质与③、⑧的最高价氧化物对应水化物的浓溶液都能发生反应,与⑧反应的化学方程式为 。
(2)现有Z、W两种中学化学中的常见物质,它们由①、③、④中的两种或三种元素组成。Z的浓溶液常温下能使铁钝化,由此可知Z的化学式为 ;W中①、③两种元素的质量比为3:14,写出W的电子式 ;W与④的单质在催化剂、加热条件下发生的反应是工业制取Z的基础,写出该反应的化学方程式: 。
(3)电动汽车的某种燃料电池,通常用NaOH作电解质,用⑥的单质、石墨作电极,在石墨电极一侧通入空气,该电池负极的电极反应 。
⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,可利用某种燃料电池,通常用硫酸溶液作电解质,用石墨作电极,在一端通入空气,另一端通入该气体,该电池负极的电极反应 。该燃料电池的产物为 。
参考答案:(1)酸性HClO4>H2SO4;C+2H2SO4(浓) CO2↑+2SO2↑+H2O
CO2↑+2SO2↑+H2O
(2)HNO3; ;4NH3+5O2
;4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)Al-3e-+4OH-=AlO2-+2H2O;SO2-2e-+2H2O=SO42-+4H+;硫酸
本题解析:根据元素在周期表中的相对位置可知,①~⑨分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)非金属性越强,最高价氧化物的水化物的酸性越强,由于酸性是HClO4>H2SO4,所以氯元素的非金属性强于S元素的。浓硫酸强于强氧化性,能与碳单质反应,方程式是C+2H2SO4(浓) CO2↑+2SO2↑+H2O。
CO2↑+2SO2↑+H2O。
(2)Z的浓溶液常温下能使铁钝化,由此可知Z的化学式为,所以Z是硝酸。W中①、③两种元素的质量比为3:14,写出W的电子式,则W是氨气,含有极性键的共价化合物,电子式是 ;氨气在催化剂的作用下,发生催化氧化生成NO和水,反应的方程式是4NH3+5O2
;氨气在催化剂的作用下,发生催化氧化生成NO和水,反应的方程式是4NH3+5O2 4NO+6H2O。
4NO+6H2O。
(3)原电池中负极失去电子,金属铝能和氢氧化钠溶液反应,则反应的电极反应式是Al-3e-+4OH-=AlO2-+2H2O;⑧的一种氧化物,通常情况为气体,是形成酸雨的主要原因之一,则该气体是SO2。SO2在反应中失去电子,则负极通入SO2,电极反应式是SO2-2e-+2H2O=SO42-+4H+;根据反应电极反应式可知,该燃料电池的产物是硫酸。
考点:考查元素周期表的结构以及元素周期律的应用、常见化学用语的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:困难
2、填空题 (15分)
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/tool
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=一1135.7kJ/mol
则肼完全燃烧的热化学方程式为?。
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,正极的电极反应式是?,电池工作一段时间后,电解质溶液的pH将?(填“增大”、“减小”、“不变”)。
 ?(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
?(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
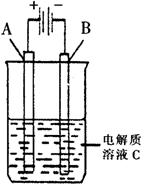
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是?。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗?molN2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因?。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)?0.1mol/LHCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H-5、Cl-、OH-、H+离子浓度南大到小的顺序为?。
参考答案:(1)N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=—534kJ/mol
(2)O2+2H2O+4e-=4OH-?减小(1分)
(3)①精炼粗铜?②0.025mol
(4)N2H4+H2O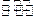 N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O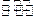 N2H+6+OH-
N2H+6+OH-
(5)大于
(6)c(N2H+5)>c(Cl-)>c(OH-)>c(H+)
本题解析:略
本题难度:简单
3、填空题 请根据反应?Fe+CuSO4=Fe?SO4+Cu,设计原电池,完成以下问题.负极:______,其电极反应式为:______
正极:______,其电极反应式为:______电解质溶液:______,电池的离子反应式为:______.
参考答案:根据金属活动性顺序表知,铁比铜活泼,结合原电池原理知,铁作负极,铜作正极,负极上电极材料失电子变成离子进入溶液,发生氧化反应;正极上,溶液中铜离子得电子生成铜单质,反应还原反应;根据反应方程式知,电解质溶液是硫酸铜,两个电极反应方程式相加得得电池反应方程式.
故答案为:Fe;Fe-2e-=Fe2+;Cu;?Cu2++2e-=Cu;CuSO4;Fe+Cu2+=Fe2++Cu;
本题解析:
本题难度:一般
4、选择题 将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是
A.电子由锌片经导线流向铜片
B.铜片作正极,锌片作负极
C.溶液中SO42- 的物质的量浓度保持不变
D.溶液中Cu2+移向负极
参考答案:D
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的铜离子在正极得到电子,所以选项A、B、C都是正确的,D不正确,溶液中Cu2+移向正极,答案选D。
点评:该题高考中的常见考点,属于基础性试题的考查,难度不大。重点考查学生对原电池原理,特别是电极名称和电极反应式书写的了解掌握情况,意在培养学生的逻辑推理能力。明确原电池的工作原理是答题的关键。
本题难度:一般
5、选择题 根据下图,判断下列说法中错误的是(? )
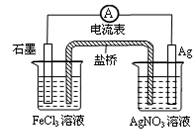
A.导线上电子由Ag极流向石墨极
B.负极电极反应式:Fe3+ + e-=Fe2+
C.盐桥中阴离子移向AgNO3溶液
D.总反应为:Fe3+ + Ag=Fe2+ + Ag+
参考答案:B
本题解析:该装置为原电池,其电池的总反应式为Fe3+ + Ag=Fe2+ + Ag+,其负极的反应为Ag-e-=Ag+,正极发生的反应为Fe3+ + e-=Fe2+;该电池中,导线上电子由Ag极流向石墨极,电流为由石墨经导线流向Ag极,故A正确;负极电极反应式:Ag-e-=Ag+,故B错误,为本题的答案;盐桥中阴离子移向AgNO3溶液,故C正确;总反应为:Fe3+ + Ag=Fe2+ + Ag+,故D正确。
点评:本题考查了原电池的基础知识,该考点是高考考查的重点和难度,本题比较容易,注意本题选择的是错误的一项。
本题难度:简单