微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历下列过程,Fe3+在pH=5时已完全沉淀,其中分析错误的是
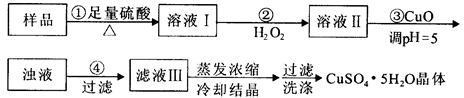
A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果
B.步骤②中发生的主要反应为:H2O2+Fe2++2H+=Fe3++2H2O
C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次
D.配制240 mL1mol/L的CuSO4溶液,需称量CuSO4·5H2O的质量为62.5g
参考答案:B
本题解析:A、CuCO3和CuO都与溶液中H+反应,起到调节溶液pH的作用,并不引入新的杂质,故A正确; B、双氧水具有氧化性,能把溶液中的亚铁离子氧化生成铁离子,因此步骤②中发生的主要反应为:H2O2+2Fe2++2H+=2Fe3++2H2O,B不正确;C、固体具有吸附性,过滤时表面有可溶性物质,可向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次,可洗涤晶体,故C正确;D、实验室没有240ml容量瓶,所以配制240 mL1mol/L的CuSO4溶液,需要250ml容量瓶,因此需称量CuSO4·5H2O的质量为0.25L×1mol/L×250g/mol=62.5g,故D正确,答案选B。
本题难度:一般
2、选择题 下列有关制取蒸馏水的装置和操作的说法中,不正确的是( )
A.蒸馏烧瓶底部必须垫石棉网
B.冷凝管内水的流向是下进上出
C.实验中需在自来水中加几片碎瓷片
D.温度计的水银球应插入蒸馏烧瓶内的自来水中
参考答案:A.蒸馏时为防止蒸馏烧瓶受热不均匀而导致炸裂,蒸馏烧瓶底部必须垫石棉网,故A正确;
B.冷凝管内水的流向是下进上出,可使冷水充满冷凝管,起到充分冷凝的效果,故B正确;
C.为防止暴沸,实验中需在自来水中加几片碎瓷片,故C正确;
D.温度计的水银球应插入蒸馏烧瓶内支管口附近,故D错误.
故选D.
本题解析:
本题难度:简单
3、实验题 某研究性学习小组拟取盐湖苦卤的浓缩液(富含Ca2+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的无水CaCl2及液溴,他们设计了如下流程:
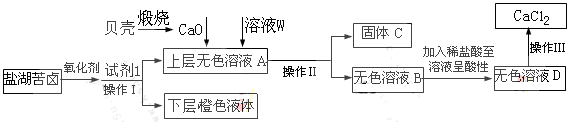
回答以下问题:
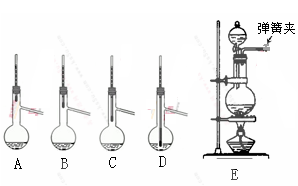
(1)操作Ⅰ中加入的试剂1是?;在从橙色液体中分离出溴时,可能会导致收集到的产品中混有低沸点杂质的装置(见图A、B、C、D)是?。
(2)加入溶液W的目的是?。
(3)操作Ⅲ所用的仪器除三脚架、酒精灯,还需要?。
(4)某同学用如上图E所示的实验装置制取操作1前的氧化剂,写出该反应的离子方程式?,试简述该装置气密性的检验方法?。
参考答案:(1)四氯化碳(或CCl4);CD(2)除去溶液中SO42-;?(3)蒸发皿、玻璃棒
(4)MnO2+4H++2Cl- Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
法一:打开弹簧夹,关闭分液漏斗活塞,将导管外接导气管,并将导气管末端插入水槽中,用手握住圆底烧瓶(或用酒精灯对其进行微热),在导气管末端有气泡产生,在松开手(或撤离酒精灯)以后,导气管末端有一段水柱上升且一段时间内不下降,则证明该装置的气密性良好。
法二:关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。
本题解析:(1)盐卤中首先加入氯水将溴化物氧化为溴单质,再加入四氯化碳作萃取剂将溴单质从水中萃取出来,再根据液态溴单质沸点与四氯化碳不同,采用蒸馏法进行分离。蒸馏时温度计的水银球应该在支管口附近,若在液面下或位置太低就会收集到低沸点的馏分。
(2)为防止产生硫酸钙沉淀,应先加入氯化钡溶液使硫酸根离子发生反应产生硫酸钡沉淀,来除去硫酸根离子。贝壳的主要成分是碳酸钙,煅烧分解得到氧化钙,将其加入其上层清液中发生反应产生氢氧化钙,镁离子转化成氢氧化镁沉淀,过滤除去,用氯化钙溶液加热蒸发得到氯化钙晶体,在把晶体在氯化氢的氛围中加热蒸干届可制取得到无水氯化钙。操作Ⅲ蒸发所用的仪器除三脚架、酒精灯,还需要蒸发皿、玻璃棒。
(4)氯气在实验室中式用二氧化锰与浓盐酸加热制取的,反应的离子方程式是:MnO2+4H++2Cl- Mn2++2H2O+Cl2↑。检验装置气密性的方法可以是关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。也可采用其他方法。
Mn2++2H2O+Cl2↑。检验装置气密性的方法可以是关闭弹簧夹,打开分液漏斗的活塞,向烧瓶中不断加水,若一段时间后水不再流下,说明装置气密性良好。也可采用其他方法。
本题难度:一般
4、简答题 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了如下装置简图.
请你参与分析讨论:
①图中仪器B的名称:______,冷却水从______进,______出;
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是______.
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:______.
④C中液体产生颜色为______;
⑤烧杯A的作用______,D中液体的作用是______.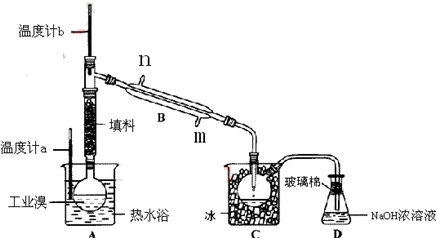
参考答案:①冷凝管是实验室常见的仪器,使用时冷凝水从下口进,上口出;
②因溴具有强腐蚀性,可以腐蚀橡胶,所以不能用橡胶塞和橡胶管;
③根据沸点不同而提纯Br2,所以要控制温度计b的温度,并收集59℃时的馏分;?
④因C中液体是溴,而液溴的颜色为深红棕色;
⑤因水浴加热使液体受热均匀;进入D装置的物质为溴蒸汽,溴蒸汽能与碱反应;
故答案为:①冷凝管;m n;
②溴具有强腐蚀性,可以腐蚀橡胶;
③要控制温度计b的温度,并收集59℃时的馏分;
④深红棕色;
⑤使液体受热均匀,与溴蒸汽反应;
本题解析:
本题难度:一般
5、实验题 (10分)已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
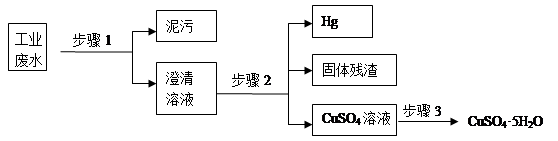
(1)步骤1的主要操作需用到的玻璃仪器除烧杯外有?。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)?,
固体残渣的成分是(填化学式)?。
(3)步骤3中涉及的操作是:蒸发浓缩、?、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是?。
参考答案:(10分)(1)漏斗、玻璃棒 (2)Cu ;Ag 、Cu (3)冷却结晶
(4)Hg蒸汽有毒
本题解析:(1)步骤1是过滤,所以需要的玻璃仪器除烧杯外有漏斗、玻璃棒。
(2)步骤2的目的是除去Ag+、Hg2+,所以应该选择的试剂是铜。因为铜能置换出银和汞,所以固体残渣是Ag 、Cu。
(3)步骤3的目的是得到硫酸铜晶体,因此操作应该是蒸发浓缩、冷却结晶、过滤、烘干。
(4)Hg易挥发,而汞蒸汽有毒,所以步骤2应该在通风橱中进行。
本题难度:一般