微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:
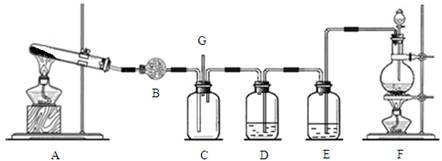
请回答:
(1)装置F中发生反应的离子方程式是?;?
(2)装置D中盛放的试剂是?,其作用是?;
(3)装置C中有白烟产生,试写出反应的化学方程式?;
(4)若从装置C的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有?的洗气瓶。
参考答案:
(1)MnO2?+ 4 H+?+ 2 Cl-  ?Mn2+?+ Cl2 ↑+ 2 H2O?
?Mn2+?+ Cl2 ↑+ 2 H2O?
(2)浓硫酸?干燥氯气?
(3)8NH3+3Cl2 ="==" N2+6NH4Cl 或
2NH3+3Cl2 ="==" N2+6HCl? NH3+HCl="=" NH4Cl
(4)氢氧化钠溶液
本题解析:略
本题难度:简单
2、选择题 实验室需配制一种强酸溶液500mL,c(H+)=2mol/L,下列配制方法可行的是
A.取100mL5mol/ LH2SO4,加入400mL水
LH2SO4,加入400mL水
B.取200mL5mol/LHCl,加水稀释至500mL
C.取100 mL 5mol/LH2SO4,加500mL水稀释
5mol/LH2SO4,加500mL水稀释
D.取100 mL5mol/LHNO3,加水稀释至500mL
参考答案:B
本题解析:略
本题难度:简单
3、填空题 利用以下装置探究氯气的性质。
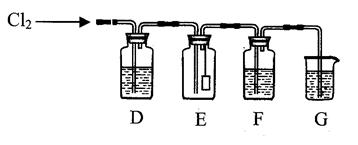
(1)写出实验室制取C12的化学方程式?;
实验室制取氯气需要用到的仪器有?(填写序号)。
①分液漏斗②碱式滴定管⑧酒精灯④圆底烧瓶⑤长颈漏斗
(2)若E中的干燥有色布条:不褪色,则D中盛有的试剂是?。
(3)G中盛有NaOH溶液,写出发生反应的离子方程式?。
(4)F中盛有蒸馏水,C12通过后可观察到溶液的颜色变为?色,说明溶液中存在?;将该溶液加入含有酚酞的氢氧化钠溶液中,溶液红色褪去。设计实验探究红色褪去的原因
?。
(5)若F中盛有的是溴化亚铁溶液,通入过量C12后,写出可能发生反应的离子 方程式?。
方程式?。
参考答案:
本题解析:略
本题难度:简单
4、实验题 下图Ⅰ、II、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:
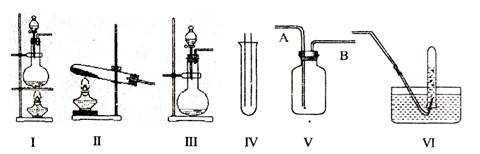
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择?;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择?;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置?,(填序号)用离子方程式表示制取氯气的反应原理是?。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从?口通入。用化学方法检验氯气收集满的方法是?。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为?mol/L。
参考答案:(1)III;II;I;MnO2 + 4H+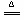 Mn2+ + Cl2 + 2H2O;(2)A;用湿润的碘化钾淀粉试纸靠近B口,试纸变为蓝色,证明氯气已集满;(3)10.5。
Mn2+ + Cl2 + 2H2O;(2)A;用湿润的碘化钾淀粉试纸靠近B口,试纸变为蓝色,证明氯气已集满;(3)10.5。
本题解析:(1)若用CaCO3与盐酸反应制CO2,由于该反应的特点为反应不加热且固体+液体→气体,则可选择装置Ⅲ;若用NH4Cl和Ca(OH)2反应制NH3,由于该反应的特点为反应需要加热且固体+固体→气体,则可选择II;若用MnO2与浓盐酸反应制取氯气,由于该反应的特点为反应需要加热且固体+液体→气体,应选用装置Ⅰ;(2)由于氯气的密度比空气的大,利用装置Ⅴ收集氯气,则应由A管口进气;依据氯气的性质,可用湿润的碘化钾淀粉试纸靠近B口,试纸变为蓝色,证明氯气已集满;(3)设在标准状况下1L的水吸收336L的HCl气体,则所得溶液中溶质的物质的量浓度为: =10.5 mol/L。
=10.5 mol/L。
本题难度:一般
5、实验题 (16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
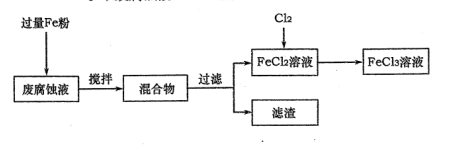
回答下列问题:
废腐蚀液中加入过量铁粉后,发生反应的离子方程式为??。
②检验废腐蚀液中含有Fe3+的实验操作是?;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、?。
③由滤渣得到纯铜,除杂所需试剂是??。
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
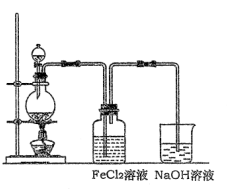
①实验开始前,某同学对实验装置进行了气密性检查,方法是?。
②浓盐酸与二氧化锰反应的化学方程式为?;
烧杯中NaOH溶液的作用是??。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于?g,
需通入Cl2的物质的量应不少于?mol.
参考答案:(1)①2Fe3++Fe=3Fe2+? Cu2++Fe=Cu+Fe2+? 2H++Fe=Fe2++H2↑
②取少量废腐蚀液置于试管中,滴加几滴KSCN溶液,溶液变无色,则证明原溶液中含有Fe3+?漏斗
③盐酸
(2)①关闭分液漏斗活塞,将导管插入水中,用手后热(或酒精灯微热)烧瓶,导管口有气泡冒出,松开手后(或停止加热)导管内出现一段水柱,证明气密性良好
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O?多余氯气,防止污染环境
MnCl2+Cl2↑+2H2O?多余氯气,防止污染环境
③39.2? 0.75
本题解析:(1)①铁粉可与Fe3+、Cu2+、H+发生反应,最终得到FeCl2溶液
②Fe3+的检验,一般用KSCN溶液,观察是否有血红色出现;过滤需要的玻璃仪器包括:漏斗、烧杯、玻璃棒
③滤渣中含有的包括过量的铁粉以及置换出的铜,故可用盐酸溶解铁粉,过滤即可得到铜
(2)①考查实验基本操作:气密性的检验
②考查氯气的实验原理及尾气吸收
③由所涉及反应可知,Fe3+、Cu2+、H+共可消耗0.7mol铁粉,即39.2g;得到的FeCl2溶液中溶质的物质的量为1.5mol,由2FeCl2+Cl2=2FeCl3可得到所需氯气的物质的量为0.75mol
本题难度:一般