微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)某研究性学习小组利用如图所示装置完成有关实验。
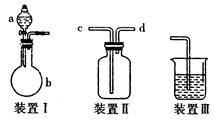
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入?。装置Ⅱ从?管口进气可作为氨气的收集装置。
【实验二】收集NO
(2)利用装置Ⅱ可收集NO,试简述操作方法:?。
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成下列表格(可以不填满,也可以再加行)
装置序号
| 仪器中所加物质名称
| 现象
|
?
| ?
| ?
|
?
| ?
| ?
|
?
| ?
| ?
2、选择题 下列气体中,既可用浓硫酸干燥,又可用碱石灰干燥的是(?)
A.Cl2
B.SO2
C.NO
D.NH3
3、选择题 .通常情况能共存,且能用碱石灰干燥的一组气体是
A.H2、O2、HCl
B.O2、NO2、NO
C.O2、NH3、H2
D.CO2、O2、NH3
4、选择题 用下图装置进行实验,下表中实验结果能说明结论的是(?)
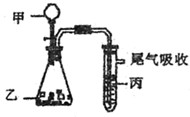
?
| 甲
| 乙
| 丙
| 结论
|
A.
水
电石
溴水
稳定性:水>C2H2>Br2
B.
盐酸
石灰石
苯酚钠溶液
酸性:HCl>H2CO3>苯酚
C.
盐酸
FeS
溴水
还原性:S2—>Br—>Cl—
D.
浓盐酸
KMnO4
KBr溶液
氧化性:Cl2> KMnO4 >Br2
|
题型:单选题难度:偏易来源:不详 答案 马上分享给同学 |