微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有金属单质A、B、H、I和气体甲、乙、丙及物质C、D、E、F、G.其中H是地壳中含量最多的金属,他们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
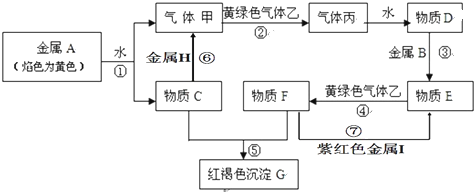
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B______;乙______.
(2)写出反应①的离子方程式:______.
(3)写出反应④的离子方程式:______.
(4)实验室检验物质F中阳离子的常用试剂为______.
(5)H与C反应的化学方程式是______.
参考答案:金属A的焰色反应为黄色,应为Na,则甲为H2,C为NaOH,H应为Al,黄绿色气体乙为Cl2,丙为HCl,D为盐酸,红褐色沉淀G为Fe(OH)3,F为FeCl3,E为FeCl2,B为Fe,紫红色金属I为Cu,
(1)由以上分析可知B为Fe,乙为Cl2,故答案为:Fe;Cl2;
(2)反应①为钠和水的反应,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)反应④为FeCl2和氯气的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)F为FeCl3,加入KSCN变红色,可用KSCN检验,故答案为:KSCN;
(5)H为Al,C为NaOH,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
本题解析:
本题难度:一般
2、推断题 已知在如图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,F是混合物,黑色物质C是某金属矿物的主要成分,有磁性,E是一种非氧化性酸,H是极易溶于水的碱性气体。

请回答下列问题:
(1)写出下列物质的化学式:A_______、C_______、I_______
(2)写出反应①的化学方程式:_________________
(3)在一定温度、压强和有催化剂存在的条件下将1molG和 2.5molD放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,则用G表示20min内的平均反应速率为____,该温度下此反应的平衡常数K=___, D的转化率为____。如果保持温度不变,再向容器中同时充入1.5molG和1molH,D的转化率将___(填“升高”“不变”或“降低”),再次平衡后H的体积分数为____。
参考答案:(1)Fe;Fe3O4;Fe(OH)3
(2)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(3)0.05mol·L-1·min-1;0.5;60%;不变;40%
本题解析:
本题难度:一般
3、填空题 (6分)A-J是中学化学中常见的物质。其中A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
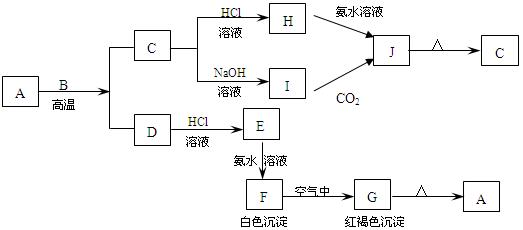
(1)写出下列物质的化学式:
A?, J?。
(2)按要求书写有关方程式:
D与稀HCl反应的离子方程式?;
B与NaOH溶液反应的化学方程式?。
参考答案:(6分) (1) A? Fe2O3 (1分)?J? Al(OH)3(1分
(2)?Fe + 2H+ ="=" Fe2++H2↑;(2分)
2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
本题解析:略
本题难度:一般
4、填空题 下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
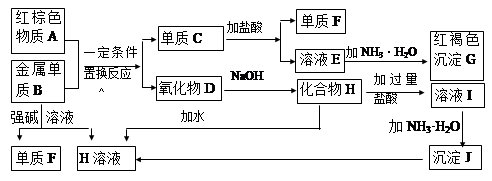
(1)G加热可分解生成A,A的化学式为________,写出物质A的一种用途?。
(2)写出单质B与强碱溶液反应的离子方程式_______________________________________,写出由沉淀J生成 H溶液的离子方程式___________________________________________.。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式_______________________,白色沉淀L会迅速变为?色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式?。
(4)溶液I中所含金属离子是_____________________。
参考答案:(1)Fe2O3(1分)?制红色油漆或涂料,作炼铁原料(1分)
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)?Al(OH)3+OH-=AlO2-+2H2O(2分)
(3)Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+(2分)?灰绿色(1分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)?(4)Na+、Al3+ (1分)
本题解析:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等,据此可以判断。红棕色固体A为Fe2O3,与金属单质B反应生成氧化物D和单质C,则该反应是铝热反应,所以B是Al,C是Fe,氧化物D能与NaOH反应,应为Al2O3,H为NaAlO2。H和过量的元素反应生成I,则I为AlCl3。氯化铝与氨水反应生成白色沉淀J,J为Al(OH)3。则铁和盐酸反应生成氢气和氯化亚铁,则F为H2,E为FeCl2。氯化亚铁与氨水反应最终生成红褐色沉淀G,则G为Fe(OH)3。
(1)氢氧化铁受热分解生成氧化铁,Fe2O3常用于制红色油漆或涂料,作炼铁原料。
(2)Al与氢氧化钠等强碱溶液反应生成氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;Al(OH)3具有两性,可与NaOH反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(3)氯化亚铁与氨水反应生成氢氧化亚铁,反应的离子方程式为Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+。Fe(OH)2不稳定,在空气中被氧化,白色沉淀迅速变成灰绿色,最终变为红褐色Fe(OH)3,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)氢氧化铝是两性氢氧化物,与过量的元素反应生成氯化钠、氯化铝和水,所以溶液I中所含金属离子是Na+、Al3+。
本题难度:一般
5、选择题 白云石的化学式是xCaCO3·yMgCO3.可用于制取耐火材料等,优质的白云石粉可作为昂贵的二氧化钛填料的替代品.现称取27.6 g白云石,加热到质量不再变化,收集到的CO2为6.72 L(已换算成标准状况).下列有关说法正确的是
A.白云石的化学式为2CaCO3·MgCO3
B.残留固体的质量为14.4 g
C.取13.8 g该白云石与足量盐酸完全反应,最多收集到标准状况下的CO22.24 L
D.27.6 g白云石与过量盐酸完全反应,可消耗HCl0.3 mol
参考答案:B
本题解析:
本题难度:一般