| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《盐类水解的原理》考点强化练习(2017年押题版)(六)
参考答案:D 本题解析:0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和后,所得溶液中含有得溶质是醋酸和醋酸钠,且二者得物质的量是相等得。由于不能确定溶液得酸碱性,因此选项A、B、C都是不一定正确得。根据物料守恒可知,选项D正确,答案选D。 本题难度:困难 3、选择题 对于0.1 mol·L-1 NH4Cl溶液,下列说法或列式正确的是 |
参考答案:C
本题解析:NH4++H2O NH3·H2O+H+,A、盐类水解是吸热反应,升高温度,平衡右移,c(H+)增加,pH减小,错误;B、根据溶液电中性:c(NH4+) + c(H+)=c(Cl-)+ c(OH-),错误;C、通入少量HCl,抑制氯化铵的水解,c(NH4+)和c(Cl-)增大,正确;D、水解的程度是微弱的,溶液显酸性,因此离子浓度的大小:c(Cl-) >c(NH4+)> c(H+) > c(OH-),错误。
NH3·H2O+H+,A、盐类水解是吸热反应,升高温度,平衡右移,c(H+)增加,pH减小,错误;B、根据溶液电中性:c(NH4+) + c(H+)=c(Cl-)+ c(OH-),错误;C、通入少量HCl,抑制氯化铵的水解,c(NH4+)和c(Cl-)增大,正确;D、水解的程度是微弱的,溶液显酸性,因此离子浓度的大小:c(Cl-) >c(NH4+)> c(H+) > c(OH-),错误。
考点:考查盐类水解及离子浓度大小比较。
本题难度:一般
4、填空题 (12分) .
(1)稀释0.1 mol·L-1氨水时,随着水量的增加而减小的是 (填写序号)。
① ②
②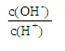 ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需的时间B>A
②开始反应时的速率A>B
③参加反应的锌粉物质的量A=B
④反应过程中的平均速率B>A
⑤A溶液里有锌粉剩余
⑥B溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的氨水和盐酸混合后,升高温度(溶质不会分解)溶液的pH随温度变化是图中的_________曲线(填写序号) 。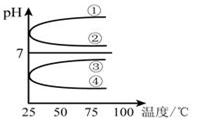
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1 NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______________ 。
(5)25℃,将a mol·L-1的氨水与0.0lmol·L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-)。则溶液显____ 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3·H2O在25℃时的电离平衡常数Kb= 。
参考答案:(1)①② ; (2)③④ ⑤; (3)④ ;(4)c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) ;(5)中 ;
本题解析:(1))稀释0.1mol·L-1氨水时 ,①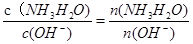 ,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb=
,平衡向电离方向移动,电离出的n(OH-)增大,比值减小;②加水稀释,虽然平衡向电离方向移动,但c(OH-)浓度减小,根据才(OH-)c(H+)乘积是定值,故氢离子浓度增大,二者比值减小;③c(H+)和c(OH-)的乘积是定值,温度不变,乘积不变;④氢氧根离子的物质的量增大,故答案选①②;(2)等pH、等体积的两份溶液A(HCl)和E(CH3COOH),醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸难度,即醋酸的反应速率快,所用时间短,①、②错误;④正确;生成的氢气的物质的量相等,说明消耗锌粉的量相等,③正确;分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸中剩余锌,⑤正确;答案为③④⑤;(3)醋酸和氨水恰好反应生成氯化铵,水解显酸性,水解反应是吸热的,故升高温度,促进水解平衡向正反应方向移动,故pH降低,答案为④;(4)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+);故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).;(5)由电荷守恒得,c(NH4+)=c(Cl-),则c(OH-)=c(H+),溶液显中性。氨水的电离常数为Kb= =
= 答案为
答案为
考点:电荷守恒、盐类的水解
本题难度:困难
5、填空题 【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。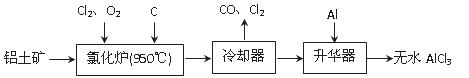
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
参考答案:(1)Al2O3+3Cl2+3C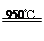 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2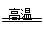 Fe3O4+CO2(1分)
Fe3O4+CO2(1分)
本题解析:⑴在氯化炉中发生的反应物有Al2O3、Cl2、C,生成物有AlCl3、CO(在冷却器中逸出),根据氧化还原反应的配平方法将其配平,并写出反应条件(950℃);
⑵书写Na2SO3溶液与Cl2反应的离子方程式时,先根据得失电子守恒有SO32-+Cl2
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《大气污染与.. | |