微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了提高SO2的转化率,通常通入过量的空气,使SO2充分和O2反应,则从接触室导出的混合气体含有
[? ]
A.SO3,O2
B.SO3,O2,N2
C.SO3,SO2,O2,N2
D.SO3,N2
2、选择题 下列事实不能用勒夏特列原理解释的是( )
A.钢铁在潮湿的空气中容易生锈
B.将FeCl3溶液加热蒸干最终得不到FeCl3固体
C.实验室可用排饱和食盐水的方法收集氯气
D.室温下,将1mLpH=3的醋酸溶液加水稀释至100mL后,测得其pH<5
3、填空题 甲酸甲酯水解反应方程式为: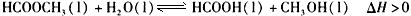
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表
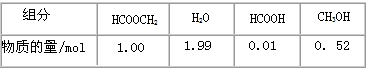
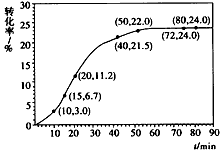
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图
|
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表
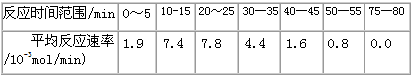
请计算15-20min范围内甲酸甲酯的减少量为________mol,甲酸甲酯的平均反应速率为________mol/min(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:___________________________________
(3)上述反应的平衡常数表达式为: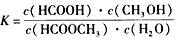 则该反应在温度T1下的K值为________________
则该反应在温度T1下的K值为________________
(4)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。______________________
4、填空题 在容积相同的不同密闭容器中内,分别充入同量的N2和H2,在不同温度下,任其发生反应: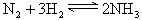 ,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
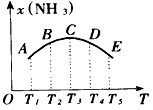
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是_____________。
(2)此可逆反应的正反应是____热反应。
(3)AC段曲线是增函数,CE段曲线是减函数,试从化学反应速率和化学平衡角度说明理由。 _____________________________________
5、填空题 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 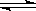 CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。
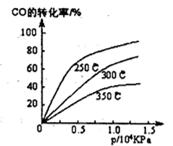
①该反应△H 0,△S 0(填“>”或“<”),则该反 自发进行(填“一定能”、“一定不能”、“不一定”)实际生产条件控制在250℃、l.3×l04kPa左右,选择此压强的理由是 。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.l" mol·L -1。
①该反应的平衡常数K= :
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 (填序号)。
A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时n(H2)/n(CH3OH)增大