微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 标况下,在三个干燥的烧瓶内分别装入干燥纯净的NH3、含一半空气的氯化氢气体、NO2和O2的混合气体[V(NO2)∶V(O2)=4∶1]。倒扣在水槽中充分作用后,三个烧瓶中所得溶液的物质的量浓度之比为?
A.2∶1∶2
B.5∶5∶4
C.1∶1∶1
D.无法确定?
参考答案:B
本题解析:假设烧瓶的容积为1 L,标准状况下假设烧瓶装满气体的物质的量为1mol。氨气极易溶于水所得的溶液溶质以氨气计算,溶液体积为1L,溶质物质的量浓度为1 mol/ L,空气和氯化氢各占一半的烧瓶倒扣水中,HCl易溶于水所得溶液的体积为烧瓶容积一半0.5L,溶质物质的量浓度为0.5 mol/0.5L="1" mol/L,对于NO2和O2的混合气体的烧瓶因为V(NO2)∶V(O2)=4∶1所以恰好完全反应所得溶液的体积的1L,NO2物质的物质的量为
0.8 mol根据反应:
4NO2+O2+2H2O=4HNO3?生成硝酸的物质的量为0.8?mol 物质的量浓度为0.8 mol/1L="0.8" mol/L.所以物质的量浓度之比为1:1:0.8,化简后为5∶5∶4。
本题难度:简单
2、实验题 分在研究性学习中,用稀HNO3与Cu反应来制备NO气体。有两位学生设计了如图所示两个实验装置(a)和(b)。回答有关问题:
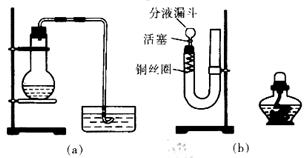
(1)写出铜与稀硝酸反应的化学方程式:________________________
(2)如果采用(a)装置,若加入20mL,6mol/LHNO3和2g薄铜片,在反应开始时,可观察到水槽内的导管中水面先慢慢上升到一定高度,此后又回落,然后有气泡从导管口冒出。试说明产生上述现象的原因:________。
(3)如果采用(b)装置,请将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到__________为止。
②关闭活塞,用酒精灯在___________微热,当反应发生时,立即撤去酒精灯。
③反应在什么情况下可以自动停止?可以在何处观察到无色的NO气体?
____________________________________________________________.
④如果再将分液漏斗的活塞慢慢打开,可立即观察到哪明显现象?
____________________________________________________________.
⑤如果需再获得N0与已生成NO2的形成鲜明对照的实验效果,应___________(填操作)。
参考答案:(12分,除注明外,每空2分)
(1)3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,故而水倒吸一定高度。O2耗完后,生成的NO开始排出导管口,故有此现象。
(3)①U形管短管中充满液体(1分) ②U形管底部(1分)
③当硝酸与铜丝脱离接触时反应自动停止,在U形管短管上部可以观察到无色NO
④U形管长管内液面下降,短管内液面上升,在分液漏斗中可观察到红棕色气体
⑤关闭分液漏斗活塞
本题解析:(1)铜与稀硝酸反应的化学方程式3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)如果采用(a)装置,若加入20mL,6mol/LHNO3和2g薄铜片,在反应开始时,可观察到水槽内的导管中水面先慢慢上升到一定高度,此后又回落,然后有气泡从导管口冒出。反应开始时产生的NO与烧瓶内空气中O2作用生成NO2,NO2溶于水并与水反应使装置内气压减小,故而水倒吸一定高度。O2耗完后,生成的NO开始排出导管口,故有此现象。
(3)如果采用(b)装置,①将活塞打开,从U形管的长管口注入稀硝酸,一直注到U形管短管中充满液体为止。②关闭活塞,用酒精灯在U形管底部微热,当反应发生时,立即撤去酒精灯。
③当硝酸与铜丝脱离接触时反应自动停止,在U形管短管上部可以观察到无色NO。
④U形管长管内液面下降,短管内液面上升,在分液漏斗中可观察到红棕色气体。
⑤如果需再获得N0与已生成NO2的形成鲜明对照的实验效果,应关闭分液漏斗活塞。3与Cu反应来制备NO气体的实验即评价。
本题难度:一般
3、选择题 日前朝鲜一辆载有硝酸铵的列车与另一辆列车相撞导致电线短路继而引发剧烈爆炸,造成重大人员伤亡。硝酸铵受撞击或高温发生爆炸的反应为:a NH4NO3→b O2+c N2+d H2O,下列关于方程式中化学计量数的说法正确的是
A.a=1
B.b= 2
2
C.c=3
D.d=4
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列块状金属中,在常温时能全部溶于足量浓HNO3的是
A.Au(金)
B.Cu
C.Al
D.Fe
参考答案:B
本题解析:金和硝酸不反应,铝和铁在浓硝酸中常温下含发生钝化。所以答案是B。
本题难度:一般
5、选择题 有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是
[? ]
A.氨气极易溶解于水的性质可以解释氨气的喷泉实验?
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
D.NH3·H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气
参考答案:AD
本题解析:
本题难度:简单