微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为?。
 ?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为?。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为?。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
物质
| △H(kJ/mol)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
?已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式?。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式?。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
?,溶液中离子浓度从大到小的顺序是?。
参考答案:
(1)
(2)436.1kJ/mol
(3)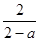
(4)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)N2+8H++6e-=2NH+4
(6)硫酸铵和硫酸氢铵;c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题解析:(1)氨气催化氧化的化学方程式为:4NH3+5O2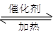 4NO+6H2O
4NO+6H2O
(2)945.6+3(H-H)-6×391.0=-92.2? H-H的键能=436.1kJ/mol
(3)N2+ 3H2 2NH3
2NH3
起始? n? 3n? 0
转化 na? 3na? 2na
平衡n(1-a) 3n(1-a)? 2na
起始的物质的量为4n,平衡时的物质的量为n(1-a)+ 3n(1-a)+2na=4n-2na
则容器内气体的压强反应前与平衡时的比值为2/(2-a)
(4)CH4和水蒸气在高温下反应得到CO和H2的热化学方程式:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)正极反应是:N2+8H++6e-=2NH4+
(6)所得溶液中的溶质是硫酸铵和硫酸氢铵,溶液中离子浓度从大到小的顺序是:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题难度:一般
2、实验题 某研究性学习小组为完成浓硝酸、稀硝酸、NO2、NO的部分实验,并有效地防止NO2、NO的污染。设计了如下图所示的装置进行实验。
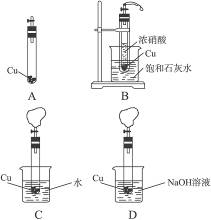
先将适量块状CaCO3和过量铜片放入底部开一小孔的试管中,塞上塞子(连有带活塞的导气管),如图A所示,再将试管放入盛有适量盐酸的烧杯中,打开活塞,发生反应:CaCO3+2HCl====CaCl2+H2O+CO2↑,用产生的CO2排尽试管内的空气。
(1)待CaCO3反应完全后,关闭活塞,在导气管上套一排尽空气的气球,然后将试管放入盛有浓硝酸的大试管中,如图B所示。再打开活塞,观察到的现象是_________________。上述现象说明____________________________________________________。有关反应的离子方程式为_____________________________________________________________________。
(2)上述反应进行一段时间后,关闭活塞,迅速将带小孔的试管取出,放入盛有适量水的烧杯中,如图C所示,再打开活塞,观察到的现象是_______________________________。
(3)关闭活塞,迅速将试管取出,放入盛有足量NaOH溶液的烧杯中,如图D所示。打开活塞,NO、NO2与NaOH溶液发生反应:2NaOH+NO+NO2====2NaNO2+H2O,气球逐渐变小,试管内液面上升。NO不能单独与NaOH溶液反应,若要将氮的氧化物完全吸收,应该如何操作?___________________________________________________。
参考答案:(1)铜片逐渐溶解,产生红棕色气体,气球逐渐膨胀,大试管中液体变为蓝色,烧杯内析出固体?铜与浓硝酸反应生成NO2气体和Cu(NO3)2蓝色溶液,该反应为放热反应? Cu+4H++2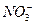 ====Cu2++2NO2↑+2H2O
====Cu2++2NO2↑+2H2O
(2)先看到气球逐渐变小,气体颜色逐渐变淡,烧杯内溶液变为浅蓝色,后气球慢慢膨胀
(3)取下气球,打开活塞(待试管内液面降到与烧杯中液面相平时),关闭活塞(此时试管内液面上升,气体颜色逐渐变淡)。重复上述操作至打开活塞不再出现红棕色为止
本题解析:根据题意弄清各仪器、试剂的作用是解题的关键。装置A相当于一个简易启普发生器,用CO2排尽试管内的空气的目的是避免NO被空气氧化成NO2而产生干扰;装置B中烧杯中饱和石灰水与反应无关,但可利用Ca(OH)2的溶解性的特殊性来检验反应是否放热;装置C中水可与气球内NO2反应3NO2+H2O====2HNO3+NO,HNO3再与Cu反应8HNO3+3Cu====3Cu(NO3)2+2NO↑+4H2O,因此气球先变小后回胀;装置D中NaOH可吸收NO2、NO混合气体,但不单独与NO反应,必须使NO与空气接触氧化成NO2再吸收。
本题难度:简单
3、选择题 将充满20mLNO的试管倒置于盛有蒸镏水的烧杯中,然后向试管里通入纯氧气,当试管内液面稳定在试管容积的4/5时,则通入O2为可能?(?)
A.9mL
B.15 mL
C.19mL
D.31mL
参考答案:C
本题解析:NO和O2在水中反应的方程式为4NO+3O2+2H2O=4HNO3。若NO过量,则参加反应的NO是16ml,消耗氧气是12ml。若氧气过量,20mLNO消耗的氧气是15ml,剩余氧气是20ml×1/5=4ml,所以通入的氧气是19ml,答案选C。
本题难度:一般
4、选择题 (12分)小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质,装置图如下:
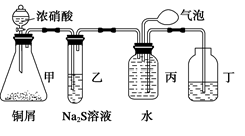
(1)写出甲中反应的离子方程式___________________________________________,乙中的现象是_______________________________,可证明NO2的氧化性;在丙中鼓入空气后现象是?,可证明NO的还原性。
(2)实验前丙中充满水的作用是_________________________________________。
(3)小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是?。
你认为怎样才能准确证明NO2的氧化性?(简要回答出原理和现象即可)_______________________________________________________________________ 。
参考答案:(12分,每空2分)
(1)Cu+4H++2NO===Cu2++2NO2↑+2H2O ?溶液变浑浊 ?有红棕色气体生成
(2) 制取NO,并用排水法收集NO
(3)NO2和水反应生成的HNO3是一种氧化性酸,可将Na2S氧化,使溶液变浑浊
可将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,即可证明NO2的氧化性
本题解析:(1)甲中为铜与浓硝酸反应,其反应的离子方程式为:Cu+4H++2NO===Cu2++2NO2↑+2H2O ;反应生成的NO2气体与Na2S反应生成S沉淀,乙中现象为黄色浑浊;丙中收集要的气体为NO,鼓入空气后生成NO2红棕色气体生成;
(2)NO2气体与水反应生成硝酸和NO,NO气体不溶于水,所以,丙中充满水的作用为制取NO,并用排水法收集NO;
(3)由于NO2气体溶于水后会与水反应生成硝酸和NO,而生成的硝酸具有强氧化性,可将将Na2S氧化,使溶液变浑浊;正确的操作方法为:可将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,即可证明NO2的氧化性
本题难度:一般
5、选择题 下列气体由于能结合血红蛋白而引起中毒的是.
①NO2? ②CO? ③H2S? ④SO2? ⑤Cl2? ⑥NO
A.②⑥
B.①②③④⑥
C.②③⑤
D.②③
参考答案:A
本题解析:题目给出的几种气体,都是大气的重要污染物,而NO、CO都易与血液里的血红蛋白结合,致使血红蛋白失去输送氧气的能力,造成人体缺氧而死亡.
本题难度:简单