|
高考化学知识点总结《磷及其化合物》高频试题强化练习(2017年最新版)(六)
2017-08-26 02:25:11
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定量的浓硝酸与过量的铜粉反应,生成的氮的氧化物 (? )
A.只有NO
B.只有NO2
C.是NO和NO2
D.无法确定
参考答案:C
本题解析:
正确答案:C
浓HNO3发生:Cu+4HNO3="Cu" (NO3)2+2NO2↑+2H2O,变稀后,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,C正确。
本题难度:简单
2、填空题 NO分子曾因污染空气而臭名昭著。Murad等三位教授最早提出NO分子在人体内有独特功能,近来此领域研究有很大进展而荣获了1998年诺贝尔医学及生理学奖。
NO对环境的危害在于(填编号,有一个或多个答案)?。
A.破坏臭氧层
B.高温下能使一些金属被氧化
C.造成酸雨
D.与人体内的血红蛋白结合
| 在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式?。
常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50度,发现气体的压强迅速下降,降至略小于原压强的2/3就不在改变,已知产物之一为N2O,写出上述变化的化学方程式?。
解释变化(3)中为什么最后的气体总压力略小于原压力的2/3?(用化学方程式表示)?。
参考答案:(1)(A)(C)(D)。
Cu+ + NO2 +2H+ ==Cu2+ +NO +H2O。
3NO=NO2+N2O
(4)2NO2=N2O4
本题解析:这是一道以科学发现为背景的综合题,涉及到环境、元素化合物的性质、氧化还原反应、阿佛加德罗定律、化学平衡等多个知识块内的知识点。另外,本题暗含社会热点、焦点问题,有利于学生积极关注人类的前途和命运。本题主要考查学生运用多个知识点和新信息解决实际问题的能力。要能解决好,同学们必须理顺各知识块之间的联系。详解如下:(1)NO中N的化合价为+2价,所以NO具有还愿性能被臭氧氧化;NO排放到空气中能最终氧化成硝酸;同CO一样NO也能与人体内的血红蛋白结合使人体缺氧而死亡。故答案为(A)(C)(D)。
根据信息可得此反应中亚铜离子为还原剂、亚硝酸根离子为氧化剂、NO为还原产物、铜离子为氧化产物,再根据电子、电荷、原子守恒可得方程式:Cu+ + NO2 +2H+ ==Cu2+ +NO +H2O。
据阿佛加德罗定律的推论可得方程式:3NO=NO2+N2O
(4)主要由于部分NO2聚合生成N2O4使气体的物质的量减小。2NO2=N2O4
本题难度:一般
3、计算题 现有N2、NH3、NO2组成的混合气体10L.此混合气体通过稀H2SO4时,溶液增重12.5g,混合气体体积减少到3.28L(体积均在标准状况下测定),则此混合气体中三种成分的体积分别是多少?
参考答案:
此混合气体中N2有1.04升,NH3有2.24升,NO2有6.72升。
本题解析:
据题意,混合气体通过稀H2SO4时的反应为:2NH3+H2SO4=(NH4)2SO4?
混合气中的NH3留在溶液中,增加了质量,并使混合气的体积缩小.同时3NO2+H2O=2HNO3+NO也使溶液增加了质量和气体体积缩小了,生成的NO气的体积是混合气中NO2体积的1/3.通过稀硫酸后的气体是原混合气中的N2和新生成的NO气的混合气体。
稀硫酸溶液质量的增加量是原混合气中NH3的量和NO2跟水反应与生成NO的质量差。
设:原混合气中的NO2为xL,NH3为yL,则N2为(10-x-y)L。
根据题意,可到方程组:
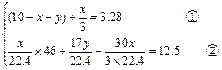 ? ? 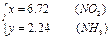
本题难度:简单
4、选择题 将氨气通过灼烧的氧化铜后,发现氧化铜变为红色,此外还收集到一种单质气体,这种气体应是(?)
A.O2
B.H2O
C.NO
D.N2
参考答案:D
本题解析:NH3与CuO的反应方程式为:2NH3+3CuO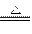 3Cu+N2+3H2O。 3Cu+N2+3H2O。
本题难度:简单
5、计算题 (12分)(1)在浓硝酸中放入铜片。
①开始反应的化学方程式为___________________________________
②若铜有剩余,则反应将要结束时的反应的离子方程式是?。
③待反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是
_____________________________________________________。
(2) 在100mL混合酸中,c(HNO3) = 0.4mol·L-1,c(H2SO4) = 0.2mol·L-1,向其中加入2.56g铜粉,微热,待充分反应后,溶液中Cu2+的物质的量浓度为?。
(3)14g铜银合金与过量的某浓度的硝酸溶液反应,待放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是?。
参考答案:(12分)
(1)① Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O (2分)
②3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O(2分)
③再加入稀H2SO4,H+与NO3―构成了氧化条件。(2分)
(2)0.15mol·L-1?(3分)
(3)3.2g(3分)
本题解析:(1)铜与硝酸反应与其浓度有关:
Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(稀)="3" Cu(NO3)2 + 2NO↑ + 4H2O
③待反应停止后,再加入少量的25%的稀硫酸提供H+,溶液中的NO3-可继续氧化铜
(2)NO3-、H+、Cu均为0.04mol,结合下面的离子方程式:
3Cu ?+ ?8H+?+?2NO3- =3Cu2+ + 2NO↑ + 4H2O
0.015mol? 0.04mol? 0.01mol? 0.015mol
溶液中Cu2+的物质的量浓度为0.15mol·L-1
(3)设合金中铜为x mol,银为 y mol
由合金质量可知:64x+108y=14?由电子守恒可得:2x+y=4×11.2/22.4
x=0.05mol? y=0.1mol
所以铜为3.2g
本题难度:一般
|