微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是(? )
A.用惰性电极电解滴有紫色石蕊试液的饱和食盐水,阴极区附近溶液先变红
B.镀锌的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
C.用惰性电极电解CuSO4溶液,在电解片刻后溶液中加Cu(OH)2固体能使CuSO4溶液恢复到电解前浓度
D.配置FeCl3溶液时,可先将其溶解在盐酸中,再用蒸馏水稀释
参考答案:D
本题解析:A中阴极是氢离子放电,阴极周围溶液显碱性,显蓝色,A不正确。锌比铁活泼,所以即使镀层部分受损后,露出的铁如果构成原电池,也是正极,被保护,B不正确。用惰性电极电解CuSO4溶液,从溶液中析出的是氧气和铜,所以在电解片刻后溶液中应该加氧化铜使溶液恢复到电解前浓度,C不正确。铁离子易水解,所以配制时用盐酸是为了防止其水解,D正确。答案选D。
本题难度:一般
2、选择题 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
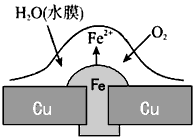
[? ]
A.正极的电极反应式为:2H++2e-=H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe流向Cu
参考答案:B
本题解析:
本题难度:一般
3、选择题 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是
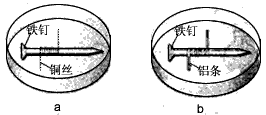
[? ]
A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
参考答案:B
本题解析:
本题难度:简单
4、填空题 (10分)如右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:
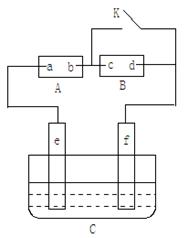
(1)电源A上的a为________极
(2)滤纸B上发生的总化学方程式为:________?__________
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d两点短路,则电极e上发生的反应式为:__________?_____,电极f上发生的反应式为:_________?_____?。若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为3.84 g,则电镀时电路中通过的电子为_____?_____mol。
参考答案:(每空2分)(1)正?
(2)2NaCl+2H2O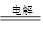 H2↑+Cl2↑+2NaOH(漏写条件扣1分,写成离子方程式不得分)
H2↑+Cl2↑+2NaOH(漏写条件扣1分,写成离子方程式不得分)
(3)Cu -2e–=Cu2+? Cu2++ 2e– =Cu? 0.06
本题解析:考查电化学的综合应用。
(1)接通电路后,发现B上的c点显红色,说明该处溶液显碱性,因此c是阴极,所以b是电源的负极,a是正极。
(2)惰性电极电解饱和食盐水使,阳极使氯离子放电生成氯气,阴极使氢离子放电生成氢气,所以总反应式是2NaCl+2H2O H2↑+Cl2↑+2NaOH。
H2↑+Cl2↑+2NaOH。
(3)电镀时待镀金属作阴极,镀层金属作阳极,失去电子。含有镀层金属离子的物质作电解质。所以要实现铁上镀铜,则e是铜,作阳极,电极反应式是Cu -2e–=Cu2+。F是铁,作阳极,溶液中的铜离子得到电子,电极反应式是Cu2++ 2e– =Cu。根据电子的得失守恒可知,阳极消耗铜的质量就是阳极析出的铜的质量,所以根据质量差可知,阳极消耗铜3.84g÷2=1.92g,物质的量是1.92g÷64g/mol=0.03mol,因此转移电子是0.03mol×2=0.06mol。
本题难度:一般
5、选择题 下列有关化学反应现象和化学原理运用的叙述一定不正确的是( )
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.无机非金属材料光导纤维能够被氢氟酸腐蚀
C.石灰石高温煅烧能分解,与此反应是熵增反应有关
D.漂粉精的主要成分是Ca(ClO)2,Ca(ClO)2难分解,但漂粉精仍需密封保存
参考答案:A.锌比铁活泼,为原电池的负极,负极发生氧化反应,正极发生还原反应,为牺牲阳极的阴极保护法,故A正确;
B.光导纤维的主要成分为二氧化硅,能够被氢氟酸腐蚀,故B正确;
C.石灰石的分解为吸热反应,生成二氧化碳气体,△S增大,故C正确;
D.Ca(ClO)2难分解,但漂粉精仍需密封保存的原因是Ca(ClO)2生成易分解的HClO,故D错误.
故选D.
本题解析:
本题难度:一般