D.石蕊溶液
参考答案:C
本题解析:滴加KSCN溶液,溶液变为血红色,证明含Fe3+,这是检验Fe3+的特征反应
本题难度:一般
3、实验题 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有K2CO3,产生的气体中含有CO、CO2。
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:①蒸馏水②3%H2O2溶液③氧化铜④1.0mol/L盐酸⑤浓硫酸⑥1.0mol/LNaOH溶液⑦澄清石灰水⑧0.5 mol/LCuSO4溶液⑨2%KSCN溶液⑩苯酚溶液
I.若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有CO2生成,应选用的试剂为(按先后顺序把所选试剂的标号填入空格内)?。
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设
假设1:只有Fe;
假设2:只有FeO;
假设3:?
(2)设计实验方案并实验验证
步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
步骤2:取少量上述不溶固体放人试管中,加入足量?溶液,充分振荡。若固体无明显变化,则假设?成立;若有暗红色固体生成,则反应的离子方程式为?。
步骤3:取步骤2所得暗红色固体于试管中,滴加过量?,振荡后静置。若溶液基本无色,则假设?成立;若溶液呈?,则假设3成立。
(3)问题讨论
若固体产物中FeO含量较少,用步骤3方法难以确定。请你设计实验方案证明假设3成立(写出实验的操作步骤、现象与结论):?
Ⅲ.拓展与延伸
有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的+3价铁还能被氯水氧化为更高价的FeO42-”,试写出该反应的离子方程式?。
参考答案:(15分)
Ⅰ.⑥、⑦、⑤、③、⑦
Ⅱ.(1)含有FeO和Fe?(1分)
(2)CuSO4溶液(1分)? 2?(1分)? Fe+Cu2+=Fe2++Cu(2分)
HCl(1分)? 1(1分)?浅绿色(1分)
(3)取步骤3静置后的上层清液,滴加几滴KSCN溶液无红色出现,再滴加1-2滴H2O2溶液,充分振荡若溶液变红,则证明假设3成立。(2分,其它合理答案均给分)
Ⅲ.2Fe3++3C12+8H2O=2FeO42-+6Cl-+16H+? (3分)
本题解析:
I.CO、CO2的检验该为先检验CO2,将CO2除尽,净化(干燥),检验CO(用CuO,变红),在检验有CO2生成(CO的氧化产物)。
Ⅱ.(1)首先铁不以三价铁形式存在,故考虑范围为二价铁的存在形式,出铁单质,氧化亚铁以为,还有可能就二者的混合物;
(2)由暗红色固体生成,可以确定为Cu,故使用的试剂为CuSO4,然后再暗红色固体(Cu、FeO)中加盐酸,溶液呈无色,说明没有Fe2+(浅绿色),故没有FeO,从而得出结论。
(3)二价铁也氧化为三价铁用KSCN进行检验,该方法比较灵敏
Ⅲ.该反应中告知反应物为Fe3+、Cl2,产物为FeO42-,然后通过氧化还原缺项配平的方法对该反应进行配平,从而得到答案。
本题难度:一般
4、填空题 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作: xH2O)。有如下操作:
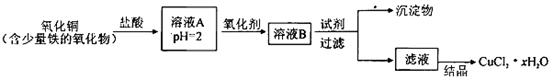
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4?②(NH4)2S?③NaOH?④ KSCN
(2)氧化剂可选用_________。①Cl2?②KMnO4?③HNO3?④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
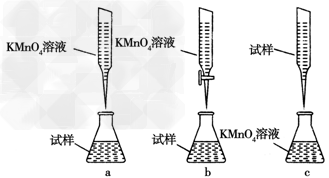
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。

(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案: xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
参考答案:(1)①(2分) (2)①④(2分) (3)③④(2分) (4)②③①(2分)
(5)250ml容量瓶(2分);b(2分) (6)二(2分);晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解(2分);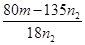 (2分) (2分)
本题解析:(1)亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,可以用酸性高锰酸钾溶液检验亚铁离子,①正确。(NH4)2S或NaOH与三种金属阳离子均反应不能检验亚铁离子,KSCN溶液只能检验铁离子,因此②③④均不正确,答案选①。
(2)由于在氧化亚铁离子时不能再引入新的杂质,氯气的还原产物是氯离子,双氧水的生成物是水,所以①④正确;氧化剂高锰酸钾会引入Mn2+、K+以及MnO4-,硝酸会引入NO3-,②③不正确,答案选①④。
(3)在调节pH值形成氢氧化铁沉淀时,仍然不能引入新的杂质。氢氧化钠会引入钠离子,氧化亚铁会引入亚铁离子,氧化铜和碱式碳酸铜与酸反应生成铜离子、水、CO2不会引入杂质,因此答案选③④。
(4)氯化铜易溶于水,所以从滤液经过结晶得到氯化铜晶体的方法是蒸发浓缩、冷却结晶然后过滤即可,因此答案选②③①。
(5)要配制一定物质的量浓度的KMnO4溶液250mL,则除了需要天平、玻璃棒、烧杯、药匙、胶头滴管外,还需要250ml容量瓶。酸性高锰酸钾溶液具有强氧化性与酸性,应该放在酸式滴定管中,因此答案选b。
(6)由于氯化铜是强酸弱碱盐,铜离子易水解生成氢氧化铜与氯化氢,水解吸热,且生成的氯化氢具有挥发,所以晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解,因此方案一是错误的,方案二正确。n2g固体是氧化铜,物质的量是 mol,则根据铜原子守恒可知氯化铜晶体的物质的量是 mol,则根据铜原子守恒可知氯化铜晶体的物质的量是 mol,则 mol,则 mol×(135+18x)g/mol=mg,解得x= mol×(135+18x)g/mol=mg,解得x=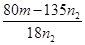 。 。
本题难度:一般
5、填空题 铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是________________;
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________;
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
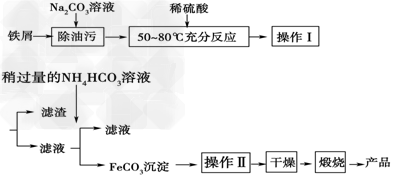
回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的方法为__________________________________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)______________________;
③请完成生成FeCO3沉淀的离子方程式____________________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250?mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________________________________。
②某同学设计的下列滴定方式,最合理的是________。(夹持部分略去)(填字母序号)
参考答案:(1)Fe2+、Fe3+、H+
(2)BC
(3)①过滤;在漏斗中加入适量蒸馏水,浸没过沉淀,让蒸馏水自然流下,重复数次;
②CO32-+H2O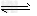 HCO3-+OH-;③Fe2++2HCO3-===FeCO3↓+CO2↑+H2O HCO3-+OH-;③Fe2++2HCO3-===FeCO3↓+CO2↑+H2O
(4)①250?mL容量瓶;②b
本题解析:
本题难度:一般
|