微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu
上述两种方法中,铜元素均被?(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
 ①证明步骤I所加FeCl3溶液过量的方法是?。
①证明步骤I所加FeCl3溶液过量的方法是?。
②步骤2中所加的氧化剂最适宜的是?。
A.HNO3? B.H2O2? C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是?。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是?(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)===CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)==2H2O(l)+O2(g)?△H2=-196kJ/mol
H2(g)+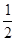 O2(g)==H2O(l)?△H3=-286kJ/mol
O2(g)==H2O(l)?△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)的△H=?。
(3)欲实现反应Cu+H2SO2==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)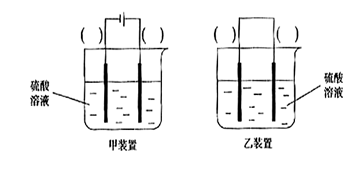
参考答案:
(1)还原
(2)方法一
①取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
②B
③CuO或Cu(OH)2(答案合理均给分)
④CuCl2在溶液中可以发生水解反应,CuCl2+2H2O Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解。
Cu(OH)2+2HCl,滴加浓盐酸,可以抑制水解。
方法二:
+64kJ/mol
(3)
本题解析:(1)两反应中铜元素化合价均降低,得电子,发生还原反应
(2)①可用KSCN溶液来检验Fe3+的存在来检验FeCl3溶液是否过量:取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
②为不引入杂质,应选用双氧水,不引入任何杂质:2Fe2++H2O2+2H+=2Fe3++2H2O
③所加物质首先必须消耗H+,并且不能引入任何杂质离子,故可选用铜的氧化物或氢氧化物:CuO或Cu(OH)2
④CuCl2在溶液中可以发生水解反应,CuCl2+2H2O Cu(OH)2+2HCl,加热时促进水解,最终得不到CuCl2·,为此可滴加浓盐酸,抑制其水解
Cu(OH)2+2HCl,加热时促进水解,最终得不到CuCl2·,为此可滴加浓盐酸,抑制其水解
方法二:依据盖斯定律①— ②—③,可得:Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)?△H=+64kJ/mol
②—③,可得:Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)?△H=+64kJ/mol
(3)反应Cu+H2SO2==CuSO4+H2不可能自发进行,必须用电解池提供电能,反应中铜化合价升高,失电子,铜应该做电解池的阳极,电解质溶液为硫酸,即采用甲装置

本题难度:一般
2、选择题 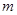 g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成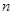 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是
A.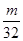 mol
mol
B.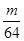 g
g
C. g
g
D. g
g
参考答案:C
本题解析:铜和浓硫酸反应的化学方程式是Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,根据S原子守恒可知,被还原的硫酸是
CuSO4+2H2O+SO2↑,根据S原子守恒可知,被还原的硫酸是 ,则质量就是
,则质量就是 g,C正确。铜的物质的量是
g,C正确。铜的物质的量是 ,因此被还原的硫酸也是
,因此被还原的硫酸也是 ,答案选C。
,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的解题思路是借助于原子守恒进行的,另外也可以根据反应的化学方程式进行计算。
本题难度:简单
3、选择题 将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A.0.1mol/L
B.0.05mol/L
C.0.2mol/L
D.无法计算
参考答案:A
本题解析:
依题意,混合物发生反应前后,反应物和生成物的关系如下:Al2O3+Fe2O3+H2SO4+NaOH Al(OH)3+Fe(OH)3+Na2SO4,易知最终溶液中NaOH全部转化为Na2SO4,根据H2SO4的量可以推算出NaOH的量来。n(H2SO4)=
Al(OH)3+Fe(OH)3+Na2SO4,易知最终溶液中NaOH全部转化为Na2SO4,根据H2SO4的量可以推算出NaOH的量来。n(H2SO4)=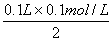 ="0.005" mol,则n(NaOH)=2n(H2SO4)="0.01" mol,c(NaOH)=
="0.005" mol,则n(NaOH)=2n(H2SO4)="0.01" mol,c(NaOH)=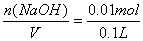 ="=0.1" mol/L。本题选A。B选项为本题的干扰选项,若没有注意到硫酸溶液的pH值与硫酸溶液浓度的关系,就容易误选B。
="=0.1" mol/L。本题选A。B选项为本题的干扰选项,若没有注意到硫酸溶液的pH值与硫酸溶液浓度的关系,就容易误选B。
本题难度:一般
4、选择题 要除去FeCl2溶液中少量的FeCl3,可行的方法是
A.滴入KSCN溶液
B.通入氯气
C.加入适量铜粉并过滤
D.加入适量铁粉并过滤
参考答案:D
本题解析:硫氰化钾溶液用于检验Fe3+,FeCl3+3KSCN Fe(SCN)3+3KCl,引入了新杂质,A错误;氯气与氯化亚铁溶液反应,B错误;铜与氯化铁反应生成氯化铜和氯化亚铁,引入了新杂质,C错误;铁与氯化铁生成氯化亚铁,过量的铁粉过滤除去,D正确。
Fe(SCN)3+3KCl,引入了新杂质,A错误;氯气与氯化亚铁溶液反应,B错误;铜与氯化铁反应生成氯化铜和氯化亚铁,引入了新杂质,C错误;铁与氯化铁生成氯化亚铁,过量的铁粉过滤除去,D正确。
点评:除杂质时要注意不能引入新的杂质、不能把主要成分除去,同时生成的物质要便于分离,如生成沉淀或生成气体等。
本题难度:一般
5、实验题 细菌冶金是一种新工艺,其能耗少、减少环境污染.称为“绿色冶金”。其原理:①氧化硫硫杆菌和聚硫杆菌能把矿石中的硫氧化成硫酸,反应式为2S+3O2+2H2O?2H2SO4,②氧化亚铁硫杆菌在上面产生的硫酸中能把硫酸亚铁氧化成硫酸铁③细菌得到了所需要的能量,生成的硫酸铁可把FeS2(黄铁矿)和Cu2S(辉铜矿)等转变为可溶性化合物而从矿石中溶解出来,其化学过程是:
Fe2S2(黄铁矿)+7Fe2(SO?4)3+8H2O?15FeSO4+ 8H2SO4
Cu2S(辉铜矿)+2Fe?2(SO4)2?2CuSO4+4FeSO4+S
(1)写出②反应的化学方程式:?。
(2)某实验小组,欲将硫酸铜和硫酸亚铁的酸性混合液分离出硫酸亚铁溶液.经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表2
物质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
|
实验室有下列试剂可供选择A.H2O2 ?B.CaO? C.CuO? D.稀H2SO4?E.铁粉;?
实验经过滤后还需设计的实验操作步骤和目的是:
实验步骤
| 实验操作
| 实验操作的目的
|
步骤1
| ?
| ?
|
步骤2
| ?
| ?
|
步骤3]
| ?
| ?
|
步骤4
| 洗涤
| ?
|
步骤5
| ?
| 得到FeSO?4溶液
|
(3)若向CuSO4、FeSO4混合液中加入适量碱液,将溶液蒸干、灼烧得到红色粉末是Fe2O3、Cu2O混合物,欲测定该混合物中Cu2O的质量分数。该实验小组的方法是向m g混合物中加人足量的稀硫酸,经过滤、洗涤、干燥、称量固体的质量为n g。已知Cu2O溶于稀硫酸生成Cu和CuSO4。某学生据此计算出该混合物Cu2O的质量分数的计算式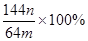 。该学生的计算是否正确:?,请说明理由?。
。该学生的计算是否正确:?,请说明理由?。
参考答案:(14分)1、4FeSO4+2H2SO4+O2=2Fe2(SO4)3+2H2O(2分)
(2)
实验步骤
实验操作
实验操作的目的
步骤1
加入H2O2
把二价铁氧化成三价
步骤2
加入适量氧化铜,调节pH到3.7
保证三价铁完全沉淀
步骤3
过滤
滤出氢氧化铁
步骤4
洗涤沉淀
除去杂质
步骤5
向沉淀中加入适量稀硫酸和适量铁粉
得到FeSO4溶液
(3)不正确(2分),因为该计算没有考虑Cu与Fe3+的反应(2分)
本题解析:(1)根据反应物和生成物可知,该反应的方程式是4FeSO4+2H2SO4+O2 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(2)pH>3.7时,Fe(OH)3已沉淀完全,而pH=6.0时Cu(OH)2才开始沉淀,则可以通过调节溶液的pH使铁元素、铜元素分离。分离时,首先将Fe2+氧化为Fe3+,氧化剂选择H2O2较好,没有杂质引入;再调节溶液的pH,选择的试剂既要消耗H+又不引入杂质,选择CuO最合适;最后需将Fe(OH)3沉淀转化为FeSO4溶液,选择稀硫酸和铁粉即可。
(3)Fe2O3、Cu2O溶于足量稀硫酸发生的反应有:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Cu2O+H2SO4 Cu+CuSO4+H2O,Cu+Fe2(SO4)3=2FeSO4+CuSO4。
本题难度:一般