微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合会发生如下反应:
NO2(g)+SO2(g)?NO(g)+SO3(g)
(1)该反应的平衡常数(K)表达式为______.
(2)该可逆反应达到平衡的标志是______(填下列序号字母?).
a.NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1:1:1:1
b.密闭容器的压强不再发生变化
c.K值不再发生变化
d.生成n?mol SO2的同时,有n?mol SO3生成
(3)在上述平衡体系中通入少量O2,平衡______移动(填“向右”、“向左”或“不”之一);NO的浓度将______(填“增大”、“减小”或“不变”之一),c(NO)与c(NO2)之和______(填“增大”、“减小”或“不变”之一).
(4)若10min后容器内SO3气体质量为4g.则在10min内用NO2浓度的变化表示反应的平均反应速率为______?mol?(L?min)-1.
参考答案:(1)该可逆反应中化学平衡常数K=[NO][SO3][NO2][SO2],故答案为:K=[NO][SO3][NO2][SO2];
(2)a.当NO2、SO2、NO和SO3四种气体的物质的量浓度之比为1:1:1:1,该反应不一定达到平衡状态,这与反应物的初始浓度及转化率有关,所以不能证明该反应达到平衡状态,故错误;
b.该反应是一个反应前后气体体积不变的可逆反应,无论反应是否达到平衡状态密闭容器的压强始终不变,所以不能证明该反应是否达到平衡状态,故错误;
c.K值只与温度有关,温度不变K值不变,所以不能证明该反应是否达到平衡状态,故错误;
d.生成n?mol SO2的同时,有n?mol SO3生成,正逆反应速率相等,所以该反应达到平衡状态,故正确;
故选d;
(3)通入少量氧气,一氧化氮和氧气反应生成二氧化氮,一氧化氮浓度减小,二氧化氮浓度增大,平衡向正反应方向移动,根据原子守恒知c(NO)与c(NO2)之和不变,
故答案为:向右?减小?不变;
(4)若10min后容器内SO3气体质量为4g,三氧化硫的平均反应速率=4g80g/mol0.5L10min=0.01mol/(L.min),根据反应方程式知,二氧化氮的反应速率和三氧化硫的反应速率相等,为0.01mol/(L.min),故答案 为:0.01.
本题解析:
本题难度:一般
2、选择题 如图,a曲线是198℃、101 kPa时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是

[? ]
A. 该反应的热化学方程式为N2+3H2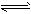 2NH3 △H=-92 kJ/mol
2NH3 △H=-92 kJ/mol
B. b曲线是升高温度时的能量变化曲线
C. 加入催化剂,该反应的反应热改变
D. 在198℃、密闭容器的体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 molN2和6mol H2反应后放出的热量为Q2 kJ,则 184>Q2>2Q1
参考答案:D
本题解析:
本题难度:一般
3、填空题 (10分)一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍: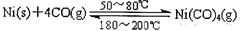 ,则该反应的△ H 0(选填“>”或“<”)。
,则该反应的△ H 0(选填“>”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
(4)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:

①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为 。
参考答案:(1)< (2)2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ·mol-1 (3)75%
(4)①CO-2e-+CO32-=2CO2 ②D ③增加6.4g
本题解析:
试题解析:(1)反应Ni(s)+4CO(g)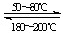 Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0;(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3="-270" kJ?mol-1;(3)设5min末消耗COamol/L,则:CO(g)+H2O(g)
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0;(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3="-270" kJ?mol-1;(3)设5min末消耗COamol/L,则:CO(g)+H2O(g) CO2(g)+H2(g),
CO2(g)+H2(g),
初始量(mol/L): 3 3 0 0
变化量(mol/L): a a a a
5min末(mol/L): 3-a 3-a a a
K=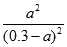 =9.0,解得a=2.2.5mol/L,故CO的转化率=
=9.0,解得a=2.2.5mol/L,故CO的转化率= ×100%=75%;(4)①CO具有还原性在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-
×100%=75%;(4)①CO具有还原性在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-
本题难度:困难
4、填空题 (4分)CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1一 [CuCl4]2- +4H2O
[CuCl4]2- +4H2O
_ 蓝色 黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴
⑵ 。
参考答案:⑴ 加硝酸银溶液 ⑵ 加水稀释
本题解析:欲使溶液由黄色变成黄绿色或蓝色,则应该使平衡向逆反应方向移动,所以可以加入硝酸银溶液生成氯化银沉淀,降低氯离子浓度;或者加水稀释,促使平衡向逆反应方向移动。
本题难度:一般
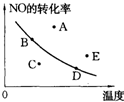
5、选择题 如图中的曲线是在其他条件一定时反应:2NO(g)+O2(g)?2NO2(g)(正反应放热)中NO的最大转化率与温度的关系.图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( ? )
A.A或E
B.C
C.B
D.D