微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:
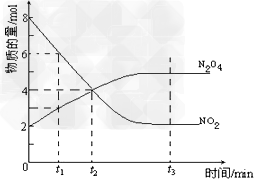
2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答
(1)在该温度下,反应的化学平衡常数表达式为:_______________
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:_________mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?____________________
(4)t1时,正反应速率______(填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向______移动?(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色___________(填“变深”、“变浅”或“不变”)
参考答案:(1)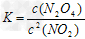 ?
?
(2)0.1
(3)t3?
(4)>?
(5)正反应应方向
(6)变深
本题解析:
本题难度:一般
2、填空题 (6分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)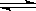 CH3OH(g)
CH3OH(g)
根据题意完成下列各小题:
(1)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
(用上图中出现的字母表示)

(2)在其他条件 不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为C u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
u2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
(4)能源问题是人类社会面临的重大课题,甲醇是未来的重要的能源物质。常温下,1g甲醇完全燃烧生成液态水时放出22. 7kJ的能量,写出甲醇燃烧热的热化学方程式 。
参考答案:

本题解析:略
本题难度:困难
3、填空题 CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
|
初始投料
| 2 molH2、1 molCO
| 1 mol CH3OH
| 4 molH2、2 molCO
|
平衡时n(CH3OH )
| 0.5mol
| n2
| n3
|
反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
|
体系的压强
| P1
| P2
| P3
|
反应物的转化率
| α1
| α2
| α3
|
①该温度下此反应的平衡常数K为 。
②三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1 D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
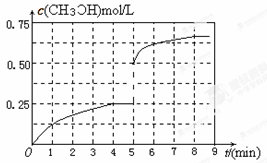
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。

(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是 ____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是 ____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
参考答案:(1)2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol
(2)正极:O2+4e-+2CO2=2CO32-
(3)①4;②AB;③如图:
(4)③>④>②>①;cd
本题解析:(1)利用盖斯定律,将所给反应I+反应II-反应III可得2CO(g)+SO2(g)=S(g)+2CO2(g) △H=+18.0kJ/mol。
(2)以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,该燃料电池的正极反应为O2+4e-+2CO2=2CO32-。
(3)①根据表格数据(甲组实验),利用三段式可得:
2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
起始浓度(mol/L):1 0.5 0
变化浓度(mol/L):0.5 0.25 0.25
平衡浓度(mol/L):0.5 0.25 0.25
所以平衡常数K=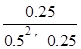 =4;
=4;
②恒温恒容条件下,实验甲和实验乙为等效平衡,甲为从正反应方向进行,乙为从逆反应方向进行,故两种情况下反应物的转化率α1+α2=1,反应放出和吸收的热量数值之和Q1+Q2=d;实验丙反应物是甲的2倍,相当于增大压强,则平衡向正反应方向移动,使反应物转化率增大,α3>α1,平衡时n3>1.0mol,P3<2P1,Q3>2Q1,故选AB。
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,压缩的瞬间,甲醇的浓度为原来的2倍,然后平衡向正反应方向移动,使甲醇浓度进一步增大,直至平衡,据此可作出CH3OH的物质的量浓度的变化曲线图像。
(4)根据题给信息可知甲酸的酸性比乙酸强,故HCOONa溶液比CH3COONa溶液水解程度小,所以四种溶液的pH由大到小的顺序为③>④>②>①;对于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液,根据物料守恒c(HCOOˉ)+c(HCOOH)=" 0.1" mo1/L;电荷守恒为c(HCOOˉ)+ c(OHˉ)=c(Na+)+c(H+),又溶液呈酸性,所以c(H+)>c(OHˉ),故c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ),将物料守恒和电荷守恒联立,可得c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+),综上,cd正确。
考点:考查盖斯定律、燃料电池电极反应式书写、化学平衡、盐类水解等相关知识。
本题难度:困难
4、选择题 常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4?2NO2△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
