|
高考化学知识点总结《原电池原理》试题巩固(2017年最新版)(十)
2017-08-26 02:46:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一原电池装置如图所示,下列有关说法正确的是( )
A.石墨电极上发生氧化反应
B.该电池负极的反应式为2Fe2+-2e-═2Fe3+
C.当有6.02×1023个电子转移时,Fe电极减少28?g
D.盐桥中Cl-移向FeCl3溶液
| 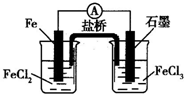
参考答案:A、装置图是原电池反应,石墨电极上是铁离子得到电子发生还原反应,故A错误;
B、负极是铁失电子发生氧化反应,电极反应为Fe-2e-=Fe2+,故B错误;
C、当有6.02×1023个电子转移时,物质的量为1mol,依据电极反应Fe-2e-=Fe2+;Fe电极减少0.5mol×56g/mol=28g,故C正确;
D、负极附近产生大量亚铁离子,盐桥中氯离子移向氯化亚铁溶液,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷
和氧气,其总反应为:2C2H6+702+8KOH=4K2C03+10H20,有关此电池的推断正确的
是(?)。
A.负极反应为:14H20+702+28e-=280H-
B.放电一段时间后,负极周围pH升高
C.每消耗1 mol C2H6,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
参考答案:C
本题解析:该装置是燃料电池,乙烷失电子发生氧化反应,应为原电池负极,负极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,A选项错误,选项中给出的为正极反应。B选项错误,放电一段时间后正极周围PH升高。C选项争取。D选项错误,根据放映方程式可知,PH值降低。
本题难度:一般
3、填空题 (12分)NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,已知键能如下:N2(g)945 kJ/mol ;O2(g)498 kJ/mol ;NO(g)630 kJ/mol
写出该反应的热化学方程式: 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO。原因是 (已知:元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强)。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
参考答案:(1)3NO2+2H2O=2HNO3+NO;(2分)(2)N2(g)+O2(g)=2NO(g) △H=+183KJ/mol;(2分)
(3)①、2NO+2CO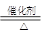 N2+2CO2 (2分) N2+2CO2 (2分)
②、由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大,金属性依次增强;(2分) (4)①、还原; (2分) ②、NO+O2--2e-=NO2;(2分)
本题解析:(1)NO2溶于水生成硝酸和NO,反应的化学方程式为3NO2+2H2O=2HNO3+NO;
(2)由于反应热=化学键断裂吸收的能量与化学键形成时放出的能量的差值,则该反应的反应热=945 kJ/mol+498 kJ/mol—2×630 kJ/mol=+183kJ/mol,所以该反应的热化学方程式为N2(g)+O2(g)=2NO(g) △H=+183KJ/mol;
(3)①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,CO被氧化为CO2,所以NO被CO还原的化学方程为2NO+2CO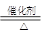 N2+2CO2; N2+2CO2;
②元素的金属性越强,金属氧化物对NOX的吸收能力就越强,由于Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大,金属性依次增强,所以金属氧化物对NOX的吸收能力逐渐增强。
(4)①氧气在Pt电极通入,因此Pt电极是正极。原电池中正极得到电子,发生还原反应。
②NiO电极是负极通入NO,NO失去电子发生氧化反应,电极反应式为NO+O2--2e-=NO2。
考点:考查氮氧化合物的性质以及原电池原理的应用
本题难度:一般
4、选择题 下图各装置中,不能构成原电池的是
[? ]
A.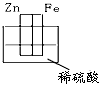
B.
C.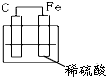
D.
参考答案:D
本题解析:
本题难度:简单
5、选择题 电子计算器所用的纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=Zn(OH)2、Ag2O+H2O+2e-=2Ag+2OH-。下列叙述中,不正确的是
[? ]
A.电子由锌经导线流向Ag2O
B.Zn是正极发生氧化反应;Ag2O是负极发生还原反应
C.Zn是负极,发生氧化反应;Ag2O是正极,发生还原反应
D.工作时,负极区域溶液的pH减小,正极区域溶液的pH增大
参考答案:B
本题解析:
本题难度:一般
| 