微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关臭氧的叙述不正确的是(? )
A.臭氧的氧化性比氧气强,常温下能将银、汞等较不活泼的金属氧化
B.臭氧可以杀死许多细菌,是一种良好的消毒剂
C.臭氧和活性炭一样,能够吸附有机色素,是一种良好的脱色剂
D.臭氧和氧气在一定条件下可以相互转化
参考答案:C
本题解析:O3能使有机色素脱色,是因为O3具有强氧化性,将有机色素氧化而脱色。
本题难度:简单
2、选择题 下列化学实验事实及其结论都正确的是
选项
| 实验事实
| 结论
|
A
| 将SO2通入含HClO的溶液中生成H2SO4
| HClO的酸性比H2SO4强
|
B
| 铝箔在酒精灯火焰上加热熔化但不滴落
| 铝箔表面氧化铝熔点高于铝
|
C
| SiO2可以和NaOH溶液及HF溶液反应
| SiO2属于两性氧化性
|
D
| 将SO2通入溴水中,酸性高锰酸钾溶液褪色
| SO2具有漂白性
参考答案:B
本题解析:A、将SO2通入含HClO的溶液中生成H2SO4,主要是HClO的强氧化性氧化SO2;B、正确;C、SiO2只能与HF酸反应与其他酸均不反应,不属两性氧化物;D、SO2使溴水、KMnO4溶液褪色主要是SO2的还原性。2的性质、铝及氧化铝的性质、SiO2的性质等内容。
本题难度:一般
3、选择题 在含2molH2SO4的浓硫酸中加入足量的Zn粉,使其充分反应,则下列推断正确的是(?)
①放出的气体中除SO2外还有H2?②只放出SO2气体,其物质的量为1mol?③反应结束时转移的电子的物质的量为4mol
A.①
B.②
C.②③
D.①②
参考答案:A
本题解析:浓硫酸中硫元素是+6价,显氧化性,故还原产物是SO2:Zn+2H2SO4(浓)  ?ZnSO4+SO2↑+2H2O;而稀硫酸是H+显氧化性:Zn+H2SO4(稀) ?ZnSO4+SO2↑+2H2O;而稀硫酸是H+显氧化性:Zn+H2SO4(稀)  ?ZnSO4+H2↑。因此,反应中既有SO2产生,又有H2产生;根据电子得失总数相等知:2molH2SO4未完全参加氧化还原反应,故转移电子的物质的量少于4mol。 ?ZnSO4+H2↑。因此,反应中既有SO2产生,又有H2产生;根据电子得失总数相等知:2molH2SO4未完全参加氧化还原反应,故转移电子的物质的量少于4mol。
本题难度:简单
4、实验题 (14分)为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。
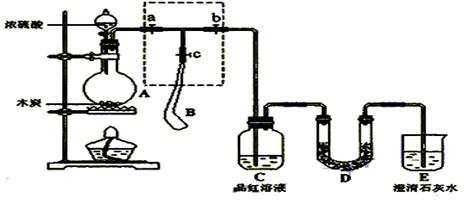 请回答下列问题: 请回答下列问题:
(1)装置A、D中发生反应的化学方程式为?;?。
(2)实验前欲检查装置A的气密性,可以采取的操作是?;
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部 分的装置,则正确的操作 分的装置,则正确的操作 顺序是?(用操作编号填写) 顺序是?(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止 水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b; 水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为?;
(5)当D中产生?现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2; 
(6)装置D的作用为?。
参考答案:(1)C +2H2SO4(浓) +2H2SO4(浓)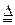 CO2↑+2SO2↑+2H2O? 2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2HO4(各2分) CO2↑+2SO2↑+2H2O? 2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2HO4(各2分)
(2)关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好。(2分)
(3)③①② (2分)
(4) 品红溶液褪色。(2分)
(5)进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变;(2分)
(6)除去SO2并检验SO2已被除净。(2分)
本题解析:略
本题难度:一般
5、选择题 下列用途中,应用了氮气不活泼性的是
A.用于合成氨气
B.用液氮做制冷剂
C.焊接金属时的保护气
D.工业上以N2为原料之一制硝酸
参考答案:C
本题解析:分析:氮气的化学性质不活泼,在一般情况下不能和其它物质发生化学反应.氮气性质较稳定,焊接金属时,用氮气隔绝空气而防止金属被氧化,可作保护气.
解答:A、用氮气制取氨气是因为氮气能和氢气反应生成氨气,与氮气的化学性质不活泼无关,故A不符合;
B、用液氮做制冷剂,利用的是液氮变化为气体吸收热量,故B不符合;
C、焊接金属时作保护气是利用了氮气的化学性质不活泼的性质,故C符合;
D、工业制备硝酸时利用氮气和氢气合成氨气,氨气催化氧化为一氧化氮进而氧化为二氧化氮,溶于水生成硝酸,不是利用氮气的不活泼性,故D不符合;
故选C.
点评:本题主要考查物质的性质和用途,物质具有多种性质,解答时应该理解物质的用途是由物质的哪种性质决定的.
本题难度:困难
|