微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下将两个铂电极插入200mLCuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g (设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。此时溶液中的pH为?
A.2
B.3-lg2
C.3
D.3+lg2
2、选择题 pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则C(H+)或C(OH-)的变化
A.c(H+)和c(OH-)都减少
B.c(H+)增大
C.c(OH-)减小
D.c(H+)减小
3、选择题 纯水在80℃时的pH ?
A.等于7
B.大于7 
C.小于7
D.无法确定
4、实验题 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
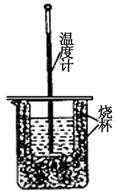
①从实验装置上看,图中尚缺少的一种玻璃仪器是?。
②大小烧杯之间填满纸屑的作用是?。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值?(填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
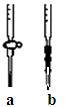
①应选择?滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;?
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,?即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
实验次数
| 起始滴定管读数
| 终点滴定管读数
|
1
| 0.00mL
| 24.04mL
|
2
| 0.50mL
| 24.46mL
|
3
| 2.50mL
| 25.02mL
|
测得未知稀盐酸的物质的量浓度为?(保留小数点后3位)。
⑤以下操作造成测定结果偏高的原因可能是?(填写字母序号)。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
5、填空题 (7分)(1)室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于?
(2)室温时,将0.1 mol/L盐酸和0.07mol/L氢氧化钡溶液1:5(体积比)混合后,该混合溶液的pH=_______
(3)某温度时,0.1 mol·L-1NaOH溶液的pH=12。该温度下,10体积pH=a的某强酸与1体积pH=b的某强碱混合后,溶液呈中性,则a和b满足的关系____________________