微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某研究小组利用题9图装置探究铜与浓硫酸反应的产物。
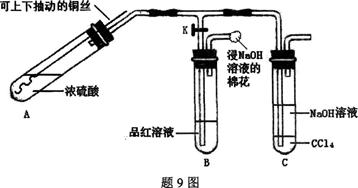
实验步骤与现象如下:
①检查装置气密性,向A中加入5 mL浓硫酸,打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K。
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热。回答下列问题:
(1)溶液中白色固体是??(填化学式),C中CCl4的作用是?。
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝。写出A中可能发生反应的化学方程式:?、?。
(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生。
①分离的操作名称为:?:
②白色沉淀为:?;
③产生白色沉淀的原因可能是?。
参考答案:(1)CuSO4;防倒吸;
(2)Cu+H2SO4(浓) CuO+SO2↑+H2O;Cu+2H2SO4(浓)
CuO+SO2↑+H2O;Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)①分液;② BaSO4;③装置中的O2参与了反应
本题解析:(1)浓硫酸在加热时发生反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。由于在浓硫酸中水很少,所以得到是无水硫酸铜CuSO4,颜色为白色。SO2有漂白性,能使某些有色物质如品红变为无色,因此装置B的品红溶液变为无色。SO2是酸性氧化物,能与NaOH发生反应:SO2+2NaOH=Na2SO3+H2O。导致导气管内的气体压强减小。而引起倒吸现象的发生,但是SO2在CCl4中不容易溶解。因此可以防止倒吸现象的发生。(2)A中可能发生反应的化学方程式为Cu+H2SO4(浓)
CuSO4+SO2↑+2H2O。由于在浓硫酸中水很少,所以得到是无水硫酸铜CuSO4,颜色为白色。SO2有漂白性,能使某些有色物质如品红变为无色,因此装置B的品红溶液变为无色。SO2是酸性氧化物,能与NaOH发生反应:SO2+2NaOH=Na2SO3+H2O。导致导气管内的气体压强减小。而引起倒吸现象的发生,但是SO2在CCl4中不容易溶解。因此可以防止倒吸现象的发生。(2)A中可能发生反应的化学方程式为Cu+H2SO4(浓) CuO+SO2↑+H2O;Cu+ 2H2SO4(浓)
CuO+SO2↑+H2O;Cu+ 2H2SO4(浓) CuSO4+SO2↑+2H2O;(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生。①分离的操作名称为:分液;②Na2SO3+BaCl2=BaSO3↓+2NaCl;2BaSO3 +O2=2BaSO4. BaSO4既不溶于水也不溶于酸。因此白色沉淀为BaSO4。③BaSO3有还原性,O2有氧化性,在溶液中发生氧化还原反应产生白色既不溶于水也不溶于酸沉淀BaSO4。
CuSO4+SO2↑+2H2O;(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生。①分离的操作名称为:分液;②Na2SO3+BaCl2=BaSO3↓+2NaCl;2BaSO3 +O2=2BaSO4. BaSO4既不溶于水也不溶于酸。因此白色沉淀为BaSO4。③BaSO3有还原性,O2有氧化性,在溶液中发生氧化还原反应产生白色既不溶于水也不溶于酸沉淀BaSO4。
本题难度:一般
2、填空题 Na2S2O3·5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃ 和70 ℃ 时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
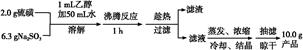
(1)实验开始时用1 mL乙醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫磺的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是? 。
(3)滤液不采用直接蒸发结晶的可能原因是? 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇? B.饱和NaCl溶液? C.水? D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol/L的标准碘水溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3 2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
参考答案:(1)A
(2)防止温度降低而使Na2S2O3晶体析出
(3)直接蒸发结晶易使Na2S2O3·5H2O熔化、分解
(4)A
(5)99.2
本题解析:(1)因为硫单质不溶于水,微溶于酒精,这里用少量乙醇的目的是让亚硫酸钠与硫磺充分接触,利于
反应。
(2)从题中所给信息看:在高温下Na2S2O3溶解度比较大,不会析出。
(3)Na2S2O3·5H2O熔化、分解温度很低,只有40多度,如果采取蒸发结晶的方法,很容易超过该温度而使制得的Na2S2O3·5H2O熔化、分解。所以采用了加热蒸发到一定浓度,降温结晶的方法。
(4)Na2S2O3·5H2O不溶于乙醇,所以采用无水乙醇洗涤。
(5)n(I2)="0.02" L×0.050 mol·L-1×20="0.02" mol,n(Na2S2O3)=2n(I2)="0.04" mol,m(Na2S2O3·5H2O)="0.04" mol×248 g·mol-1="9.92" g,Na2S2O3·5H2O的纯度为: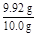 ×100%=99.2%。
×100%=99.2%。
本题难度:一般
3、选择题 接触室里装一个热交换器,其主要目的是()
A.冷却反应后的混合气体,使SO3凝华后析出
B.给催化剂加热
C.把反应放出的热量传递给需要预热的反应混合气体
D.降低接触室的温度,以免温度过高烧坏设备
参考答案:C
本题解析:接触室里装一个热交换器只是为了在冷却产物气体的同时预热原料气体,从而提高能量的利用率,以降低成本,提高效益。
本题难度:简单
4、选择题 下列关于SO2的说法中,不正确的是
A.SO2是硫及某些含硫化合物在空气中燃烧的产物
B.SO2具有漂白性,可以使品红溶液褪色
C.SO2与水反应生成H2SO4
D.SO2是一种大气污染物,它主要来自于化石燃料的燃烧
参考答案:C
本题解析:
答案:C
C.不正确,SO2与水反应生成H2SO3;
硫及某些含硫化合物,化石燃料的燃烧,都产生SO2,是大气污染物,是酸性氧化物,能与水、碱、部分氧化剂、还原剂反应,具有漂白性,可以使品红溶液褪色。A、D、B均正确。
本题难度:一般
5、选择题 BaSO4在医学上用作钡餐的理由,其中正确的是(?)
①既不溶于水又不溶于酸?②对人体无害?③不易被X射线透过?④有治疗疾病的作用
A.只有①
B.①和③
C.①和④
D.②和③
参考答案:B
本题解析:在人体的胃液中有盐酸,而BaSO4不溶于酸。
本题难度:简单