微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)右图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g?28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是______.
(2)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量
1
n(H2SO4):n(Fe)>1:1
介于Ⅰ级~Ⅱ级之间
2
n(H2SO4):n(Fe)<1:1
优于Ⅰ级
|
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制______过量为最佳.
(3)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀______;乙同学查资料后认为该灰绿色沉淀是由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3的缘故,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路______.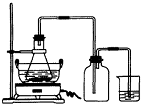
参考答案:(1)根据m=ρVω知,要计算溶液的体积还需要知道98%硫酸的密度,故答案为:98%硫酸的密度;
(2)硫酸和铁的质量比确定了产品的级别,从Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,可以看出,三价铁的含量越低级别越高,从表中可以看出,只要控制铁过量,产品级别就高,故答案为:铁;
(3)由资料信息可知,氢氧化亚铁为白色而氢氧化铁为棕色,二者的混合物呈现出绿色,因此实验中出现灰绿色或绿色的现象应是生成的Fe(OH)2部分被氧化而混入少量的Fe(OH)3的缘故;资料中提及的微绿色Fe3(OH)8,可理解为Fe(OH)2与Fe(OH)3的结合起的一种物质,其中既有+2价铁也有+3价铁,因此改写为氧化物的形式时,8个氢原子应结合成4H2 O,所以应写成:FeO?Fe2O3?4H2O,
由于出现的沉淀由白变绿是因为形成了Fe(OH)2与Fe(OH)3的混合沉淀,因此可利用向Fe2+和Fe3+的混合液中直接加入NaOH溶液,反应生成Fe(OH)2与Fe(OH)3的混合沉淀物,观察此时沉淀物的颜色,或直接取Fe(OH)2与Fe(OH)3进行混合,观察混合后颜色的方法,以解释沉淀由“白”变“绿”的现象,
故答案为:FeO?Fe2O3?4H2O;向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色.或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色.
本题解析:
本题难度:一般
2、实验题 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5?mol·L-1、2?mol·L-1、18.4?mol·L-1)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:?

(1)甲同学表中实验步骤②为__________________
(2)甲同学的实验目的是__________________要得出正确的实验结论,还需控制的实验条件是__________________
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。乙同学在实验中应该测定的数据是______________________
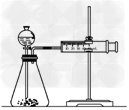
(4)乙同学完成该实验应选用的实验药品是________________该实验中不选用某浓度的硫酸,理由是________________________
参考答案:(1)分别投入大小、形状相同的Cu、Fe、Al
(2)研究金属(或反应物)本身的性质与反应速率的关系;温度相同
(3)一定时间内产生气体的体积(或产生一定体积的气体所需时间)
(4)Fe(或Al)、0.5 mol·L-1硫酸和2 mol·L-1硫酸;常温下Fe(或Al)在18.4 mol·L-1硫酸中钝化
本题解析:
本题难度:一般
3、实验题 (10分)在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH?="=" K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04? ="=" K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203="=" Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用?滴定管移取步骤 ③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是:?;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是?;
(3)步骤④的A溶液最合适的是?;滴定终点的判断方法是?;
(4)步骤④应该选用?(填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
序号
| 滴定前/mL
| 滴定后/mL
|
①
| 1.35
| 19.40
|
②
| 1.05
| 19.00
|
③
| 1.58
| 20. 91 91
|
根据数据计算该样品中总二氧化硫的浓度为?mol/L,故该干白葡萄酒是?(填“合格”“不合格”)产品。
参考答案:(10分)
(1)I2+SO2+2H2O==4H++2I-+SO42-;(2分)
(2)防止SO2逸出和被空气中氧气氧化;(1分)
(3)淀粉;(1分)
当滴入最后一滴时,溶液颜色由蓝色变成无色,并在30S内不变成蓝色;(若出现“30S内不褪色”或类似的字语不给分;)(2分)
(4)酸式;(1分)
(5)0.003200(2分)(未保留4位有效数字,只得1分),?不合格。(1分)
本题解析:略
本题难度:一般
4、实验题 (15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出实验的方案即可),证明镁元素的金属性比铝元素强。
试剂:镁条、铝条、氯化铝溶液、氯化镁溶液、稀盐酸、氢氧化钠溶液
方案一:_____________________________________________________________;
方案二:_____________________________________________________________。
Ⅱ.利用下图装置可验证同周期元素非金属性的变化规律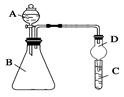
(1)仪器A的名称为________,干燥管D的作用为________________。
(2)若要证明非金属性:Cl>S,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加___________,观察到C中溶液___________________________的现象,即可证明。反应的离子方程式为________________________________________________________。
从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(3)若要证明非金属性:N>C,则在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。该实验原理为______________________________。但有的同学在实验中一切操作正确的情况下没观察到上述现像,试分析可能的原因是___________________________。
参考答案:Ⅰ(1)方案一:用形状大小相同的铝条和镁条分别一等体积等浓度的稀盐酸反应,观察其反应速率快慢?(2分)
方案二:分别向等体积等浓度的氯化铝溶液、氯化镁溶液中加入氢氧化钠溶液至过量,观察其沉淀及其溶解情况(2分)
Ⅱ(1)分液漏斗;防倒吸(每空1分)
(2)硫化钠溶液(1分)有黄色沉淀生成(1分) S2-+Cl2=2Cl-+S↓(2分) 氢氧化钠溶液(1分)
(3)利用非金属元素最高价氧化物对应水化物酸性强弱来比较元素非金属性强弱 (2分)?硝酸有挥发性,随二氧化碳一起逸出(2分)
本题解析:Ⅰ(1)方案一:判断金属性强弱可以依据金属与酸反应的剧烈程度,因此可以设计金属与相同浓度的盐酸生成气体的剧烈程度判断镁和铝金属性强弱;
方案二:根据氢氧化镁、氢氧化铝是否溶于强碱设计,过量碱液可使生成的Al(OH)3溶解,而Mg(OH)2则不溶,具体方法:分别向等体积等浓度的氯化铝溶液、氯化镁溶液中加入氢氧化钠溶液至过量,观察其沉淀及其溶解情况;
Ⅱ(1)根据仪器结构特点可知A为分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;
(2)若要证明非金属性:Cl>S,可以利用单质之间的置换反应。B中产生氯气,则在C中加入硫化钠溶液,;氯气与硫化钠分子置换反应生成氯化钠和单质硫,所以观察到C中溶液有黄色沉淀生成的现象,即可证明,反应的离子方程式为S2-+Cl2=2Cl-+S↓;氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气;
(5)要证明非金属性是N>C,则可以利用最高价氧化物水化物的酸性强弱来比较,依据较强的酸可以制备较弱的酸可知,如果在A中加稀硝酸,B中加碳酸钙,则B中产生CO2,CO2能使澄清石灰水变浑浊,因此C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。由于硝酸有挥发性,随二氧化碳一起逸出进入澄清的石灰水,因此没观察到上述现像。
本题难度:一般
5、实验题 某化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
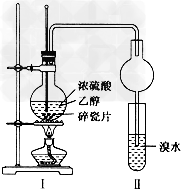
(1)写出该实验中生成乙烯的化学方程式______________
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是____________
A.乙烯与溴水易发生取代反应 ?
B.使溴水褪色的反应,未必是加成反应 ?
C.使溴水褪色的物质,未必是乙烯 ?
D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是_______________________。为验证这一反应是加成而不是取代,可用pH试纸来测试反应后溶液的酸性,理由是____________________。
(4)丙同学对上述实验装置进行了改进,在I和Ⅱ之间增加如下图所示装置,则A中的试剂应为______________,其作用是_____________,B中的试剂为____________________
(5)处理上述实验后烧瓶中废液的正确方法是__________
A.废液经冷却后倒入下水道中?
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸
参考答案:(1)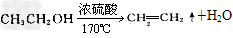
(2)BC
(3)液体分层,油状液体在下;若发生取代反应则生成HBr,水溶液的pH明显减小,若发生加成反应,水溶液的pH将增大
(4)NaOH溶液;除去SO2气体;品红溶液?
(5)C
本题解析:
本题难度:一般