|
高中化学知识点归纳《物质组成与性质实验方案的设计》考点强化练习(2017年押题版)(八)
2017-08-26 02:54:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
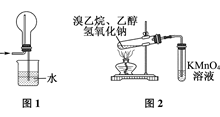
1、选择题 下列有关实验原理或操作正确的是( )
A.SO2气体的还原性较强,不能使其通过浓硫酸干燥
B.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
C.用图1装置吸收多余的HCl气体
D.用图2装置检验溴乙烷发生消去反应生成乙烯
| 
参考答案:C
本题解析:A错,浓硫酸不能氧化二氧化硫,可以干燥;
B错,滴定管洗净后经蒸馏水润洗后还要用标准液润洗两到三次;
C正确,因HCL气体极易溶于水,可使圆底烧瓶内压强急剧减少,形成喷泉;
D错,从发生装置中出来的气体除了乙烯气体外,还有乙醇蒸气,乙醇蒸气也能使高锰酸钾溶液褪色;所以要先通入水中除去乙醇再将气体通入高锰酸钾溶液。
本题难度:一般
2、选择题 对下列实验现象的解释正确的是( )
| 选项 | 实验现象 | 解释
A
Cl2可使含有酚酞的氢氧化钠溶液褪色
干燥的氯气具有漂白性
B
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
说明该溶液中含有SO42-
C
SO2可使酸性KMnO4溶液褪色
SO2具有漂白性
D
浓硝酸在光照下颜色变黄
浓硝酸不稳定
|
A.A
B.B
C.C
D.D
参考答案:A.干燥的氯气不具有漂白性,氯气与水反应生成具有漂白性的HClO,故A错误;
B.硝酸具有强氧化性,可与SO32-反应生成SO42-,溶液中不一定含有SO42-,故B错误;
C.SO2具有还原性,与酸性高锰酸钾发生氧化还原反应,故C错误;
D.硝酸不稳定,光照条件下易分解,浓硝酸在光照下颜色变黄,是由于分解生成二氧化氮的原因,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 某学生在做乙醛的还原性实验时,取1mol/L CuSO4溶液和1mol/L NaOH溶液各1mL, 在一支洁净的试管内混合后,向其中又加入0.5mL乙醛溶液,然后水浴加热,结果无红色 在一支洁净的试管内混合后,向其中又加入0.5mL乙醛溶液,然后水浴加热,结果无红色 沉淀出现,该同学实验失败的原因可能是?(?) 沉淀出现,该同学实验失败的原因可能是?(?)
A.加入乙醛太多
B.加入乙醛太少
C.加入NaOH溶液的量不够
D.加入CuSO4溶液的量不够
参考答案:C
本题解析:略
本题难度:简单
4、实验题 I、亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含
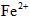 34%~36%,是糖衣片,……,与 34%~36%,是糖衣片,……,与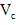 (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验: (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(1)第一步:查阅资料得知,双氧水可以氧化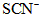 生成 生成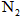 、 、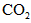 和SO42-,也可以将 和SO42-,也可以将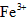 氧化成 氧化成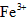 。 。
(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有Fe2+离子存在;
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量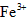 离子存在。该离子存在的原因可能是(填序号):___________________ 离子存在。该离子存在的原因可能是(填序号):___________________
①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成。
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中。
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的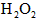 溶液,溶液的红色先变深,之后红色逐渐褪去。 溶液,溶液的红色先变深,之后红色逐渐褪去。
①红色变深的原因是(用离子方程式表示):__________________________;
②请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:____________________。
(6)第六步:向B试管的溶液中加入一片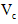 片,片刻后溶液红色也褪去,说明 片,片刻后溶液红色也褪去,说明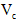 有___________性。 有___________性。
II、以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S,CuFeS2+4Fe3+=Cu2++5Fe2++2S, 2Fe3+ + H2S = 2H+ + S↓ + 2Fe2+。下图为该工艺的示意图。
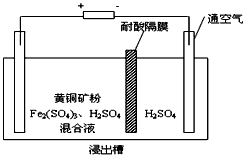
(1)电解过程实现了Fe3+的循环,则阳极方程式为___________________ 。
(2)电解过程中阴极有金属析出,向阴极通空气的原因是________________________。
(3)与燃烧法炼铜相比,电解法的优点为________________________。
参考答案:I、
(3)②③;
(5)①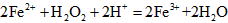 , ,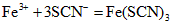 ; ;
②取一支试管,加入少量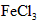 溶液和几滴 溶液和几滴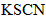 溶液,溶液变为红色,再加入适量 溶液,溶液变为红色,再加入适量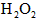 振荡,产生气泡,红色褪去,说明是 振荡,产生气泡,红色褪去,说明是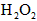 氧化了溶液的 氧化了溶液的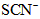 离子使溶液褪色; 离子使溶液褪色;
(6)还原性
II、
(1)Fe2+-e-=Fe3+
(2)氧气与硫酸、铜反应生成硫酸铜
(3)不产生二氧化硫污染空气
本题解析:
本题难度:困难
5、实验题 下面是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置如下图所示。
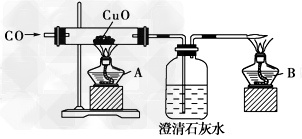
(1)点燃酒精灯A、B的先后顺序为:先__________后____________。
(2)硬质试管中发生反应的化学方程式为 __________________。
(3)洗气瓶中的实验现象为 _____________________。
(4)酒精灯B的作用为 _______________________。
(5)乙同学提出甲的装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导气管出口旋转到A的火焰上即可。乙同学的设计是否合理?简述理由(从A、B使用的一致性的角度考虑)__________________________________________________。
(6)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应。试对此作出评 价,你认为丙的设计 价,你认为丙的设计
___________?(填“必要”或“不必要”)。)。
参考答案:(1)B;A
(2)CuO+CO Cu+CO2 Cu+CO2
(3)澄清石灰水变浑浊
(4)点燃CO,防止CO污染环境
(5)不合理,因为CO点燃在先,CuO加热在后,不能同时进行
(6)不必要
本题解析:
本题难度:一般
| 