微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各溶液中,微粒的物质的量浓度关系表述正确的是(?)
A.将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1 :20
B.0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+ c(H2CO3) +2 c(CO32-)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:
c(Na+)+ c(H+)=c(A-) +c(Cl-)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等
参考答案:A
本题解析:B.0.1 mol/L NaHCO3溶液中,由物料守恒可知,c(Na+)=(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.将0.2mol/LNaA溶液和0.1 mol?L-1盐酸溶液等体积混合所得碱性溶液中,溶液不显电性,则由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),故C错误;
D.碱抑制水的电离,能水解的盐可促进水的电离,则pH=l2的Ba(OH)2溶液水电离的c(H+)=10-12mol/L,pH=12的Na2CO3溶液中水电离的c(H+)=10-2mol/L,故D错误;
故选A。
点评:本题考查离子浓度大小的比较,熟悉溶液中的电荷守恒、物料守恒、盐的水解及电离等知识即可解答,题目难度中等,选项BC为易错点。
本题难度:简单
2、选择题 欲使醋酸溶液中的CH3COO-溶液增大,且不放出气体,可加入下列物质中的(? )
A.氢氧化钠
B.碳酸氢钠
C.醋酸钠
D.镁
参考答案:AC
本题解析:使醋酸溶液中的CH3COO-溶液增大,可加入物质与H+反应使醋酸电离平衡向电离的方向移动,如氢氧化钠、碳酸氢钠及金属镁,但碳酸氢钠和金属镁与H+反应会放出H2,故氢氧化钠符合题意;而加入醋酸钠,虽使醋酸电离平衡向左移动,但剩余的CH3COO-的浓度仍是增加的,所以加入醋酸钠也符合题意。
本题难度:简单
3、实验题 某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
温度(℃)
| 10
| 20
| 30
| 50
| 70
| 80
| 100
|
pH
| 8.3
| 8.4
| 8.5
| 8.9
| 9.4
| 9.6
| 10.1
|
?
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8。
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊。
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5。
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8。
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1。
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)___________
________________、_______________________________。这两个平衡以_______________
为主,理由是_______________________________.
(1)实验3得到的结论是__________________________________________________。
(1)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是_____________
__________、______________________、________________________________。
(1)实验4①得到的结论是_______________________________________________。
(1)实验4②“加水至200mL”的目的是____________________________________________。
实验4③可以得到的结论是_______________________________________。
(1)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________________。
参考答案:(本题共12分,每空1分)
(1)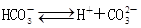 、
、 水解平衡,溶液显碱性
水解平衡,溶液显碱性
(2)加热0.1mol/LNaHCO3溶液,NaHCO3发生分解反应或促进水解平衡,产生二氧化碳。
(3)水分蒸发,NaHCO3发生分解反应,NaHCO3水解平衡被促进
(4)相同温度下,Na2CO3的水解能力和溶液碱性大于NaHCO3
(5)排除因水分蒸发导致pH增大的因素。NaHCO3常温下即可发生分解反应或碳酸氢钠水解平衡和二氧化碳溶解平衡移动。
(6)是NaHCO3发生分解生成碳酸钠?还是水解平衡向右移动?还是两者皆有。(相关合理答案均可得分)
本题解析:(1)NaHCO3为弱酸酸式盐,可发生电离,也发生水解反应,根据实验1表中数据可知NaHCO3溶液呈碱性,所以以水解为主。
(2)加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊,说明生成的气体为CO2。
(3)实验2温度升高,溶液的pH增大,说明加热促进了NaHCO3的水解,实验三生成了CO2,可能为NaHCO3发生了分解反应。
(4)Na2CO3溶液的pH大,说明Na2CO3溶液的碱性强,水解程度大。
(5)加水至200mL,与原溶液体积相同,排除因水分蒸发而导致pH增大;常温下溶液的pH增大,可能是NaHCO3在常温下分解,也可能是NaHCO3的水解程度增大,或CO2的溶解平衡移动造成的后果。
(6)NaHCO3溶液加热后pH增大,可能为NaHCO3发生分解生成碳酸钠,也可能是NaHCO3水解平衡向右移动,或者两种都有,需要进一步研究。
本题难度:困难
4、选择题 下列物质的水溶液能导电,但属于非电解质的是
A.HNO3
B.SO2
C.NaHCO3
D.Cl2
参考答案:B
本题解析:分析:电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答:A.HNO3在水中能电离,则其水溶液导电,即HNO3属于电解质,故A错误;
B.SO2的水溶液能导电,是因SO2和水反应生成亚硫酸,亚硫酸电离生成离子而导电,即发生电离不是SO2本身,故SO2属于非电解质,故B正确;
C.因NaHCO3在水溶液或熔化状态下都能导电,则NaHCO3属于电解质,故C错误;
D.因非电解质是化合物,而Cl2是单质,即Cl2既不是电解质也不是非电解质,故D错误.
故选B.
点评:本题考查电解质和非电解质,难度不大,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.
本题难度:困难
5、选择题 下列实验,不能说明乙酸是弱电解质的是
A.常温时,测得乙酸钠溶液的pH>7
B.常温时,测得0.1 mol·L-1乙酸溶液的pH约为3
C.乙酸溶液与大理石反应产生气泡
D.相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱
参考答案:C
本题解析:A、乙酸钠溶液的pH>7 说明乙酸根离子是弱离子水解,正确; B、乙酸部分电离出氢离子,是弱电解质,正确;C、酸的性质,错误;D、导电能力强溶液中离子浓度大,说明乙酸没能完全电离,正确。
本题难度:一般