微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH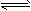 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
[? ]
A.加入少量NaOH固体,平衡向逆反应方向移动
B.加水,反应速率加快,平衡向逆反应方向移动
C.滴加少量0.lmol/L HCl溶液,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向逆反应方向移动
参考答案:D
本题解析:
本题难度:一般
2、选择题 将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
[? ]
A.c(H+)
B.Ka(HF)
C.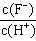
D.
参考答案:D
本题解析:
本题难度:一般
3、填空题 (6分)写出下列物质在水中的电离方程式
(1)硫酸氢钠
(2)碳酸 ,
参考答案:(1)NaHSO4=Na++H++SO42- (2)H2CO3 H++HCO3- ;HCO3-
H++HCO3- ;HCO3- H++CO32-
H++CO32-
本题解析:硫酸氢钠是强酸的酸式盐,电离方程式是NaHSO4=Na++H++SO42-;碳酸是二元弱酸,分步电离,存在电离平衡,因此电离方程式是H2CO3 H++HCO3-;HCO3-
H++HCO3-;HCO3- H++CO32-。
H++CO32-。
考点:考查电离方程式的书写
点评:该题是基础性试题的考查,难度不大。试题基础性强,学生不难得分。该题的关键是明确电解质的强酸,然后灵活运用即可。该题有利于培养学生的规范答题能力。
本题难度:一般
4、选择题 用蒸馏水稀释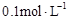 的醋酸至
的醋酸至 ,稀释过程中温度维持25℃不变,下列各项中始终保持增大趋势的是?(?)
,稀释过程中温度维持25℃不变,下列各项中始终保持增大趋势的是?(?)
A.c(H+) c(OH— )
c(OH— )
B.c(H+)
C.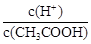
D.
参考答案:C
本题解析:醋酸是弱酸,稀释促进电离,所以氢离子的物质的量是增加的,但氢离子浓度是降低,所以OH-浓度是增加的B不正确;稀释过程中,醋酸分子的个数是减小的,所以选项C正确;温度不变,水的离子积常数和电离常数都是不变的,即选项AD不正确,答案选C。
本题难度:一般
5、选择题 100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示。下列说法正确的(?)
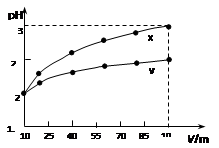
A.x为弱酸,y为强酸
B.稀释前x、y的物质的量浓度相等
C.随着稀释的进行,y的电离程度减小
D.等体积的x、y分别分别与足量的锌反应,y放出的氢气多
参考答案:D
本题解析:从图上分析,X,Y两种一元酸体积都扩大了10倍,如果两者都是强酸,那么PH值根据稀释原理和PH值计算会从2升高到3,但实际的结果是X升高到3,Y并没有升高那么多,这说明X是强酸,Y是弱酸,只有弱酸中存在电离平衡,在稀释的时候,会电离出H+来削弱PH值升高这种趋势。
由上述理由可推知:A错误,X为强酸,Y为弱酸。
B错误,Y这种弱酸只能部分电离,要使得Y的PH值与X相同,那么Y的浓度必须大于X。
C错误,稀释使电离平衡正向移动,Y的电离程度应该增大。
D正确,因为Y的浓度大于X,在等体积的情况下,Y的物质的量也是大于X的,能产生的氢气在金属足量的情况下要多于X。
本题难度:一般