微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.有些活泼金属如铝可用作热还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.使元素由化合态转化成游离态的过程就是还原的过程
参考答案:A
本题解析:A、有些活泼金属如铝可用作热还原法的还原剂,如铝热反应,正确;B、冶炼金属钠用电解熔融NaCl的方法,错误;C、冶炼铝用电解熔融氧化铝的方法,不可用焦炭或一氧化碳还原氧化铝的方法,错误;D、使元素由化合态转化成游离态的过程可能是氧化过程,也可能是还原的过程,错误。
本题难度:一般
2、选择题 某课外小组欲测定过氧化钠与碳酸钠混合物中过氧化钠的质量分数,准确称量a克样品,下列后续实验方案中,不合理的是
A.隔绝空气加热,冷却后,称量剩余固体质量m1g
B.与足量稀盐酸反应并蒸干,称量剩余固体质量m2g
C.与足量水反应并加热,收集到标准状况下V1L干燥气体
D.与足量稀硫酸反应并加热,收集到标准状况下V2L干燥气体
参考答案:A
本题解析:隔绝空气加热,Na2O2和Na2CO3都不分解,冷却后质量不变,不能计算各组分的量,A不可行。与足量稀盐酸反应并蒸干,根据Na守恒列方程可求解,B可行;足量水反应并加热,收集到标准状况下的干燥气体是O2,可计算Na2O2的量,C可行;与足量稀硫酸反应并加热,收集到标准状况下干燥气体是O2和CO2,可通过列方程组计算各组分的量,D正确。
本题难度:一般
3、实验题 (16分)有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
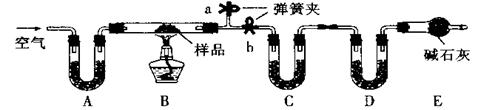
(1)实验时,B中发生反应的化学方程式为
?,?。
(2)装置C、D中盛放的试剂分别为:
C?,D?(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是?,它在该实验中的主要作用是?
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将?(填“偏高”、“偏低”或“无影响”)。
(5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为:?(结果用分数表示,可不化简)。
参考答案:(1)2NaHCO3  ?Na2 CO3 + H2O + CO2↑? Na2CO3·10H2O
?Na2 CO3 + H2O + CO2↑? Na2CO3·10H2O  ?Na2CO3 + 10H2O
?Na2CO3 + 10H2O
(2)无水CaCl2?碱石灰
(3)(球形)干燥管?防止空气中的CO2和水蒸气进入影响测定结果
(4)偏低?(5)286(m1 - 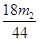 )/180m ×100%
)/180m ×100%
本题解析:(1)B中盛放的是固体混合物,所以加热时反应的方程式为2NaHCO3  ?Na2 CO3 + H2O + CO2↑、Na2CO3·10H2O
?Na2 CO3 + H2O + CO2↑、Na2CO3·10H2O  ?Na2CO3 + 10H2O。
?Na2CO3 + 10H2O。
(2)C是吸收水蒸气的,D是吸收CO2的,U形管中不能放液体干燥剂,所以试剂分别是无水CaCl2和碱石灰。
(3)根据E的结构可知,E是干燥管。由于空气中也含有水蒸气和CO2,所以E的作用是防止空气中的CO2和水蒸气进入影响测定结果。
(4)如果是氢氧化钠溶液,则水蒸气的含量将增加,则碳酸钠和碳酸氢钠的质量将增加,所以氯化钠的质量减少。
(5)生成CO2是m2g,则碳酸氢钠产生的水是m2/44×18g,所以碳酸钠生成的水是(m1-m2/44×18)g,所以碳酸钠晶体的质量是286(m1-18m2/44)/180,因此质量分数是286(m1-18m2/44)/180m ×100%。
点评:化学实验解题的关键就是要审清题意,然后分析好各个装置的作用,这样才能轻松解决每个问题。
本题难度:一般
4、计算题 t ℃时,将一定质量的钠投入到24.6 g水中,恰好得到t ℃时的饱和溶液31.2 g,则投入的钠的质量为多少克?t ℃时,NaOH的溶解度为多少?
参考答案:6.9 g? 62.5 g
本题解析:2Na+2H2O="===2NaOH?" +? H2↑
2×23? 2×40? 2
m(Na)?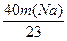 ?
?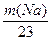
据质量守恒m(Na)+24.6 g-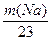 ="31.2" g
="31.2" g
m(Na)="6.9" g
m(NaOH)="12" g
设溶解度为S,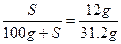
解出S="62.5" g。
本题难度:简单
5、选择题 一定质量的钾、钠投入一定量的稀盐酸中,产生的气体的质量(纵轴m)随时间(横轴t)变化曲线如图:则下列说法正确的是(已知钾的还原性比钠强)
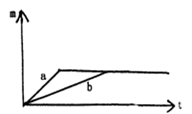
A.曲线a为钠,曲线b为钾
B.投入的Na的质量小于K的质量
C.投入的Na、K的质量一定相等
D.两个反应的盐酸中HCl必须足量
参考答案:B
本题解析:钾比钠活泼,所以反应速率快,因此a曲线表示钾。由于生成的氢气相等,所以消耗的钠的质量小于钾的质量,答案选B。
本题难度:一般