微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 把4mol?A和4mol?B混合放入容积为2L的密闭容器里,发生反应3A(g)+2B(g)═x?C(g)+2D(g),经5s后反应达平衡.在此5s内C的平均反应速率为0.1mol?L-1?s-1,同时生成2mol?D.试计算:
(1)达到平衡状态时B的转化率;
(2)试算x的值;
(3)若温度和压强维持不变,当生成2mol?D时,此时容器内气体的体积是多少?
2、选择题 如图是表示:2X (g)+Y (g) ?Z (g)+R (g)?⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
?Z (g)+R (g)?⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是

A.减少Z物质
B.加大压强
C.升高温度
D.使用催化剂
3、选择题 一定温度下,在容积为2L的密闭容器中发生反应C0(g)+H20(g) C02(g)+H2(g),部分数据见下表(表中t2>t1):
C02(g)+H2(g),部分数据见下表(表中t2>t1):
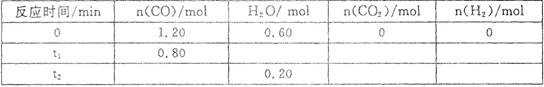
下列说法正确的是
A.反应在t1 min内的平均速率为
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)="0.60" mol, n(H20)=" 1.20" mol,则平衡时n(C02)=" 0." 20 mol
4、选择题 下列图示与对应的叙述相符的是

A.由图甲可以判断:若T1>T2,反应A(g)+ B(g) 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
5、填空题 (14分)金属钛素有“太空金属”、“未来金属”等美誉。工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下图所示。?

已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼?烧”所需主要仪器有?。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 ? 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O?未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为?(用小数表示,保留二位小数)。