微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某溶液中含有Cl-、K+、H+、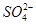 ,组成该溶液的化合物最多有(?)
,组成该溶液的化合物最多有(?)
A.2种
B.3 种
C.5种
D.6种
参考答案:C
本题解析:根据离子的种类可知,该溶液可以组成的化合物有KCl、HCl、K2SO4、H2SO4、KHSO4,共计是5种,答案选C。
点评:该题关键是按照顺序逐一排列,同时还必须符合客观事实,本题容易漏选酸式盐KHSO4。
本题难度:一般
2、选择题 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3 → 3O2↑+ 2Cl2↑+ 4HClO4 + 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:_________→___________(填化学式)。
该反应的氧化产物是____________(填化学式);所得混合气体的平均式量为_______。
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为____________________________。若将该反应设计成原电池,则在正极生成的离子是___________(填离子名称)
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是_________(填序号)。
a. KMnO4> Cl2? b. Cl2> O2? c. HIO4> HClO3? d. HIO4> Cl2
参考答案:(本题共8分)(1)HClO3 → Cl2(1分);? O2? HClO4(1分) 47.6 (1分)
(2)2Mn2+ + 5IO4— + 3H2O → 2MnO4— + 5IO3— + 6H+(2分);碘酸根离子(1分)(3)a、d(2分)
本题解析:(1)根据方程式可知,氯酸钾中氯元素的化合价由+5价部分降低到0价,得到电子,被还原。部分升高到+7价,失去电子,被氧化。另外氧元素的化合价从-2价升高到0价,失去电子,被氧化,所以发生还原反应的过程可表示为HClO3 → Cl2,其中氧化产物是O2和HClO4。所得混合气体是氧气和氯气,二者的体积之比是3:2,所以混合气的平均式量为(3×32+2×71)÷5=47.6。
(2)由于将锰离子转化为高锰酸根离子,所以锰离子是还原剂失去电子,因此IO4—是氧化剂,其还原产物是IO3—,所以该离子反应方程式为2Mn2+ + 5IO4— + 3H2O → 2MnO4— + 5IO3— + 6H+。原电池中正极得到电子,发生还原反应,所以根据离子方程式可知,在正极发生反应的离子是IO4—,而生成的离子是IO3—。
(3)在氧化还原反应中氧化剂的氧化性强于氧化产物,因此根据反应的方程式可知,氧化性应该是HIO4>KMnO4>Cl2,答案选ad。
本题难度:一般
3、选择题 在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是(? )

A.a→b时的沉淀的成分为BaSO4与Mg(OH)2
B.b→c时发生的离子反应为:H+ + OH— → H2O
C.c→d时离子的物质的量:Ba2+可能大于Cl—
D.d→e时离子的物质的量:Ba2+一定大于OH—
参考答案:B
本题解析:往混合溶液中加Ba(OH)2溶液,开始阶段发生的反应为Ba2++SO42- +2H+ + 2OH— = BaSO4↓+ 2H2O,图像为a-b段;当SO42- 被完全沉淀时,还有2mol H+?,所以继续滴加Ba(OH)2溶液,发生的反应为H+ + OH— = H2O,无沉淀产生,图像为b-c段,该阶段消耗Ba(OH)2 1mol;再继续滴加Ba(OH)2溶液,发生反应为Mg2++ 2OH— = Mg(OH)2↓,所以沉淀有增多,图像为c-d段,当镁离子完全被沉淀,则沉淀不再增多,图像保持d-e段趋势。所以正确的是B,选B。
本题难度:一般
4、选择题 下列各组离子能大量共存的是
A.Na+、Ba2+、S2-、SO42-
B.H+、K+、SO32-、SO42-
C.Fe2+、H+、ClO-、S2-
D.K+、NH4+、SO42-、NO3-
参考答案:D
本题解析:离子间如果发生化学反应,则不能大量共存,反之可以。A中生成硫酸钡沉淀,B中生成SO2和水,C中ClO-能氧化亚铁离子和硫离子,所以正确的答案选D。
本题难度:一般
5、选择题 在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是
A.Na+、Cu2+、Cl-、SO42-
B.Ba2+、K+、OH-、NO3-
C.K+、Ca2+、NH4+、CO32-
D.H+、Ca2+、Cl-、HCO3-
参考答案:B
本题解析:分析:根据离子之间不能结合生成沉淀、气体、水等,则能大量共存,并结合离子的颜色来解答.
解答:A.该组离子之间不反应,能共存,但Cu2+为蓝色,与无色溶液不符,故A错误;
B.该组离子之间不反应,能共存,且均为无色,故B正确;
C.因Ca2+、CO32-结合生成沉淀,则不能共存,故C错误;
D.因H+、HCO3-结合生成水和气体,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,熟悉复分解反应发生的条件及离子的颜色即可解答,题目较简单.
本题难度:一般