| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《化学平衡》高频考点预测(2017年最新版)(十)
参考答案:B 本题解析: 本题难度:一般 3、选择题 已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( ) |
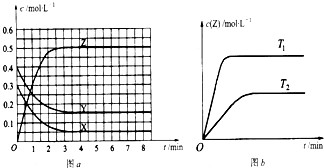
参考答案:C
本题解析:
本题难度:简单
4、选择题 多孔纳米TiO2具有良好的吸附性和催化活性,可广泛用做光敏催化剂。上海市复兴路隧道的路面上就涂了一层多孔纳米TiO2光敏催化剂,它能使汽车尾气中50%的NO和CO转化为无毒物质,其反应为
2NO(g)+2CO(g)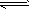 N2(g)+2CO2(g) △H=-746. 6kJ/mol。下列有关叙述中不正确的是
N2(g)+2CO2(g) △H=-746. 6kJ/mol。下列有关叙述中不正确的是
[? ]
A.多孔纳米TiO2光敏催化剂能加快汽车尾气中NO与CO的反应速率
B.该反应中NO是氧化剂
C.该反应中每消耗2molNO,放出746. 6kJ热量
D.温度越高,NO和CO的转化率越大
参考答案:D
本题解析:
本题难度:一般
5、填空题 (12分)某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g) 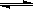 H2 (g)+I2 (g)
H2 (g)+I2 (g) 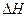 =" +A" kJ·mol
=" +A" kJ·mol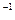 K=4.0)
K=4.0)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol HI | 1 mol H2 + 1 1mol I2 | 2 mol HI + 1 mol H2 + 1 mol I2 |
HI的浓度(mol·L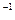 ) ) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | 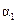 | 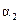 | 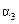 |
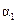 与
与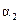 的关系式为
的关系式为  平衡常数表达式为 。
平衡常数表达式为 。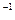 ·min
·min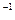 (用含有c2的代数式表示)
(用含有c2的代数式表示) 左”、“向右”或“不动”)
左”、“向右”或“不动”)参考答案: (12分)
(1)①2c1=c3②a+b=A③2p2=p3④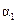 +
+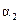 ="1 " (各2分)
="1 " (各2分)
(2)c(H2)
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的量》.. | |