微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应2A(气)+xB(气)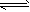 4C(气)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为
4C(气)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为
[? ]
A.1
B.2
C.3
D.4
参考答案:A
本题解析:
本题难度:一般
2、填空题 (14分)(1)已知:Fe(s)+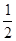 O2(g)=FeO(s) △H=-272.0kJ?mol-1
O2(g)=FeO(s) △H=-272.0kJ?mol-1
2Al(s)+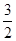 O2(g)=Al2O3(s) △H=-1675.7kJ?mol-1
O2(g)=Al2O3(s) △H=-1675.7kJ?mol-1
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
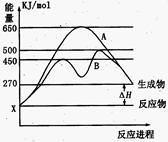
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(S)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
参考答案:(1)2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s) △H=-859.7 kJ?mol-1
(2)①吸;增大 ②D (3)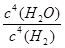 减小 (4)①107:1 ②>;c>a>b>d
减小 (4)①107:1 ②>;c>a>b>d
本题解析:(1)①Fe(s)+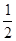 O2(g)=FeO(s)△H=-272.0kJ?mol-1,②2Al(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-1,②2Al(s)+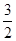 O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1,依据盖斯定律②-①×3得到热化学方程式为:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s) △H=-859.7 kJ?mol-1;
O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1,依据盖斯定律②-①×3得到热化学方程式为:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s) △H=-859.7 kJ?mol-1;
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,反应物的转化率增大;
②由图可知,反应历程B与A相比,改变反应历程,活化能降低,应是使用催化剂,故答案为:D;
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以可逆反应Na2SO4(S)+4H2(g) Na2S(s)+4H2O(g)的平衡常数表达式k=
Na2S(s)+4H2O(g)的平衡常数表达式k=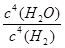 ;K1000℃<K1200℃,这说明升高温度平衡常数增大,即平衡向正反应方向移动,因此正反应为吸热反应。降低体系温度,平衡向逆反应方向移动,混合气体总质量减小,总的物质的量不变,故混合气体的平均相对分子质量将减小;
;K1000℃<K1200℃,这说明升高温度平衡常数增大,即平衡向正反应方向移动,因此正反应为吸热反应。降低体系温度,平衡向逆反应方向移动,混合气体总质量减小,总的物质的量不变,故混合气体的平均相对分子质量将减小;
(4)①盐溶液中c(OH-)=10-14÷10-8=10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水电离出的氢氧根离子浓度,即c(H+)=c水电离(OH-)=10-14÷0.1=10-13 mol/L,所以混合液中由水电离出的OH-浓度与0.1mol?L-1NaOH溶液中由水电离出的OH-浓度之比=10-6 mol/L:10-13 mol/L=107:1;
②将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性;NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性;(NH4)2CO3溶液中碳酸根的水解程度更大,pH值最大。
考点:考查热化学方程式的书写、化学平衡常数、平衡移动、电解质溶液有关计算、盐类水解等
本题难度:困难
3、填空题 (14分)将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)  2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数
| 1min
| 2min
| 3min
| 4min
| 5min
| 6min
| 7min
|
条件I
| 26%
| 42%
| 52%
| 57%
| 60%
| 60%
| 60%
|
条件II
| 20%
| 33%
| 43%
| 52%
| 57%
| 65%
| 65%
|
(1)在条件I到达平衡时,计算该反应的平衡常数K,要求列出计算过程。
(2)在条件I从开始反应到到达平衡时,H2的反应速率为____________。
(3)为达到条件II的数据,对于反应体系可能改变的操作是_______________。
(4)该反应的△H_____0(填">","<"或"=")
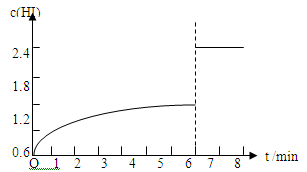
(5)在条件I下达到平衡后,在7min时将容器体积压缩为原来的一半。请在图中画出c(HI)随时间变化的曲线。
参考答案:(1)设I2消耗浓度为x
I2(g) + H2(g)  2HI(g)
2HI(g)
起始浓度(mol/L): 0.8 1.2 0
转化浓度(mol/L): x x 2x
平衡浓度(mol/L):0.8-x 1.2-x 2x (2分)
(三行中的数值无浓度或量的单位示意扣1分)
HI的体积分数为60%,则:2x/2=60%,x="0.6" mol/L (1分)
K=c2 (HI) /[c(H2)·c(I2)]=1.22/(0.2×0.6)=12 (1分)
(2)0.12 mol/(L·min) (2分,单位错扣1分)
(3)降低温度 (2分)
(4)< (2分)
(5) (4分,两段各2分)
本题解析:(1)根据化学平衡计算平衡时各物质的浓度,设I2消耗浓度为x
I2(g) + H2(g)  2HI(g)
2HI(g)
起始浓度(mol/L): 0.8 1.2 0
转化浓度(mol/L): x x 2x
平衡浓度(mol/L):0.8-x 1.2-x 2x
HI的体积分数为60%,则:2x/2=60%,x="0.6" mol/L,再根据平衡常数的计算公式K=c2 (HI) /[c(H2)·c(I2)]进行计算,K=1.22/(0.2×0.6)=12。(2)氢气的反应速率=0.6/5=0.12mol/(L·min)。(3)根据表格分析,相同时间内,碘化氢的体积分数变化小,说明速率慢,温度低。(4)平衡时碘化氢的体积分数大,说明降温平衡正向移动,△H<0。(5) 体积压缩到原来一半,则碘化氢的浓度变成原来2倍,平衡不移动,所以图像为:

考点:化学平衡状态的计算和判定。
本题难度:困难
4、选择题 恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min
| n(MgSO4)/mol
| n(CO)/mol
| n(CO2) / mol
|
0
| 2.00
| 2.00
| 0
|
2
|
| 0.80
|
|
4
|
|
| 1.20
|
下列说法正确的是
A.反应在0~2min内的平均速率为v(SO2)=0.6 mol·L-1·min-1
B.反应在2~4min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
参考答案:BD
本题解析:A、根据题给反应知,v(SO2)=v(CO),反应在0~2min内的平均速率为v(SO2)=v(CO)=1.2÷(2×2)="0.3" mol·L-1·min-1,错误;B、分析题给数据知反应在2~4min内反应处于平衡状态,容器内气体的密度没有变化,正确;C、根据题给数据计算该反应的平衡常数K=[SO2][CO2]/[CO](0.6×0.6)/0.4=9/10,升高温度,反应的平衡常数变为1.00,平衡正向移动,则正反应为吸热反应,错误;D、保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,相当于题干平衡减小压强,平衡正向移动,根据等效平衡知识知到达平衡时n(CO2)>0.60mol,正确。
考点:考查化学平衡。
本题难度:一般
5、填空题 将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB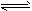 cC(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了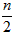 mol,C增加了
mol,C增加了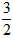 n mol,D增加了n mol,此时达到化学平衡。
n mol,D增加了n mol,此时达到化学平衡。
(1)该化学方程式中各物质的化学计量数为:
a =_____________,b =_____________,c =_____________,d =____________。
(2)若只改变压强,反应速率发生变化,但平衡不移动,该反应中各物质的聚集状态:
A_____________,B_____________,C_____________,D_____________。
(3)若只升高温度,反应一段时间后,测得四种物质的物质的量又达到相等,则该反应为
_____________反应(填“放热”或“吸热”)。
参考答案:(1)2;1;3;2
(2)气态;固态或液态;固态;气态
(3)放热
本题解析:
本题难度:一般