微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol·L—1KOH溶液,下列说法不正确的是?(?)
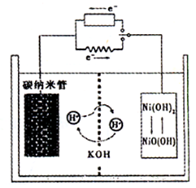
A.储存H2的碳纳米管放电时为负极,充电时为阴极
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为 NiO(OH)+H2O+e—===Ni(OH) 2+OH—
D.放电时,电池反应为2H2+O2===2H2O
参考答案:D
本题解析:A正确,储存H2相当于燃料电池,燃料通入的是负极,当充电时,为阴极;B正确,放电时,负极为氢气得电子生成氢离子与溶液中的氢氧根离子反应,即负极附近pH减小;C正确,正极为电子流向的一极,正极的电极反应为? NiO(OH)+H2O+e—===Ni(OH) 2+OH—;D错,H2+ 2NiO(OH)===2 Ni(OH) 2
本题难度:一般
2、填空题 (18分)C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
离子半径
| 还原性
| 得电子能力
|
N3- Al3+
| O2- S2-
| 35Cl 37Cl
|
(3)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
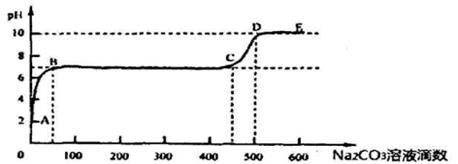

请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
参考答案:(1)二 、IVA 、 14C (每空1分,共3分)
(2)大于 小于 等于(每空1分,共3分)
(3)①CaCO3(s)+ 2HCl(aq)= CaCl2(aq)+ H2O(l) +CO2(g)?H =" -10a" kJ/mol (2分)
②Ca2++ CO32-= CaCO3↓(2分)
(4)H2-2e-+2OH- = 2H2O(2分)
本题解析:(1)C元素位于元素周期表第二周期,IVA族,常用14C测定文物年代,这种同位素的符号为14C;
(2)N3-与 Al3+的电子层结构相同,则原子序数小的离子半径大,所以离子半径:N3-大于Al3+;O的氧化性大于S,则O2-的还原性小于S2-;35Cl与 37Cl都是Cl元素的不同原子,化学性质相似,所以得电子能力相同;
(3)①CaCO3和适量HCl溶液反应时生成二氧化碳气体,氯化钙、水,所以4.4g二氧化碳的物质的量是4.4g/44g/mol=0.1mol,则1mol碳酸钙与适量HCl溶液反应放出的热量是10akJ,则该反应的热化学方程式为CaCO3(s)+ 2HCl(aq)= CaCl2(aq)+ H2O(l) +CO2(g)?H =" -10a" kJ/mol;
②因为二氧化碳能溶于水,使氯化钙溶液显酸性,所以开始加入的碳酸钠与溶解的二氧化碳反应,BC段的pH保持不变,说明此时加入的碳酸钠与氯化钙反应生成碳酸钙沉淀,离子方程式为Ca2++ CO32-= CaCO3↓;
(4)氢氧燃料电池中负极发生氧化反应,所以在负极发生反应的是氢气,电解质溶液是氢氧化钠,则氢气失去电子,与电解质溶液中的氢氧根离子结合为水,所以负极的电极反应式为H2-2e-+2OH- = 2H2O。
考点:考查元素位置的判断,离子半径、还原性的判断,热化学方程式的书写,原电池电极反应式的书写
本题难度:困难
3、选择题 对铜—锌—稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是(?)
A.锌片溶解了32.5克
B.锌片增重了32.5克
C.铜片上放出了1克氢气
D.铜片上放出了1mol氢气
参考答案:AC
本题解析:原电池中较活泼的金属作负极,失去电子,发生氧化反应,不活泼的金属作正极。所以锌是负极,失去电子被溶解。铜是正极,溶液中的氢离子得到电子,生成氢气。1mol锌失去2mol电子,生成1mol氢气。所以当导线中通过1mol电子时,消耗的锌是32.5g,生成0.5mol氢气,因此正确的答案是AC。
本题难度:一般
4、选择题 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是(?)
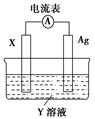
A.电解质溶液Y是CuSO4溶液
B.电极X的材料是Cu
C.银电极为电池的正极,其电极反应为Ag++e-=Ag
D.外电路中的电子是从X电极流向Ag电极
参考答案:A
本题解析:解答本题时应注意以下两点:
(1)由氧化还原反应拆成两个半反应可知,Cu作原电池负极;
(2)根据得电子的离子选取电解质溶液。
本题难度:一般
5、填空题 (14分)运用化学反应原理研究NH3的性质具有重要意义。
(1)科学家一直致力于“人工固氮”的新方法研究。据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质。在使用催化剂b和不使用催化剂a时,该反应过程和能量的变化关系如图所示。
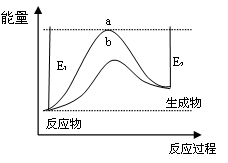
①写出该反应的化学方程式?。
②a和b相比,二者的平衡常数关系是Ka?Kb(填“>”、“=”或“<”)
③升高温度,平衡时NH3的含量?(填“增大”、“不变”或“减小”)
(2)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g) + 3H2(g)  ?2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2)?v逆(N2)(填 “>” 、“="”" 或 “<”)
?2NH3(g) ΔH <0。400℃时,K= 0.5,某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则该反应的v正(N2)?v逆(N2)(填 “>” 、“="”" 或 “<”)
(3)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
 ?浓度mol.L-1 ?浓度mol.L-1
时间
| c(NH3)
| c(O2)
| c(NO)
|
0min
| 1.000
| 1.600
| 0.000
|
2min
| 0.600
| a
| 0.400
|
4min
| 0.500
| 0.975
| 0.500
|
6min
| 0.500
| 0.975
| 0.500
|
8min
| 0.700
| 1.225
| 0.750
|
①则2 ~4min内,v(O2) = ??。
②在第8min时改变条件,你认为改变的条件可能是?。
(4)常温下,向0.001 mol·L-1的AlCl3溶液中通入NH3直至过量,现象?,当PH = ?时,开始生成沉淀(已知:Ksp[Al(OH)3]= 1.0×10-33)。
参考答案:(1)① 2N2 + 6H2O?
 ?4NH3 + 3O2?(2分)?
?4NH3 + 3O2?(2分)?
②? =?(1分)?③增大?(1分)
(2)? <?(2分)
(3)① 0.0625 mol/(L·min)?(2分)
②增大NO的浓度(或增加NO的物质的量)?(2分)
(4)生成白色沉淀?(2分)? 4?(2分)
本题解析:(1)①根据反应前后原子守恒可知,单质是氧气,所以反应式为2N2 + 6H2O?
 ?4NH3 + 3O2。
?4NH3 + 3O2。
②催化剂能降低反应的活化能,但不能改变平衡常数,所以平衡常数是不变的。
③根据图像可知,反应物的总能量低于生成物的总能量,反应是吸热反应。升高温度平衡向正反应方向移动,氨气的含量增大。
(2)某一时刻测得N2、H2和NH3三种物质物质的量分别为2mol、1mol和3mol,则其浓度分别为4.0mol/L、2.0mol/L、6.0mol/L。所以此时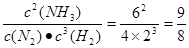 >0.5,所以反应逆反应方向移动,即正反应速率小于逆反应速率。
>0.5,所以反应逆反应方向移动,即正反应速率小于逆反应速率。
(3)①氨气发生催化氧化的方程式为4NH3+5O2 4NO+6H2O,在2 ~4min内,氨气浓度的变化量是0.600mol/L-0.500mol/L=0.100mol/L,所以氧气的浓度变化量是0.125mol/L,则反应速率为
4NO+6H2O,在2 ~4min内,氨气浓度的变化量是0.600mol/L-0.500mol/L=0.100mol/L,所以氧气的浓度变化量是0.125mol/L,则反应速率为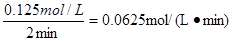 。
。
②4min时反应达到平衡状态,而在第8min时,氨气、氧气和NO的浓度均增大,所以只能是增大了生成物NO的浓度,平衡向逆反应方向移动。
(4)根据氢氧化铝的溶度积常数可知当铝离子浓度是0.001mol/L时,溶液中OH-的浓度为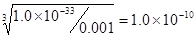 ,则氢离子浓度为10-4,所以pH等于4.
,则氢离子浓度为10-4,所以pH等于4.
本题难度:一般