微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
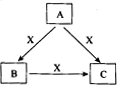
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为___________。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为____________________________________________________________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_______________________。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
参考答案:(1)①Al(或铝元素)?②2Al+Fe2O3 = 2Fe+Al2O3
(2)①PCl3的电子式略?②PCl5+4H2O=H3PO4+5HCl
(3)① 离子键和共价键?②c(Na+)> c(HCO3-)>c(CO32-)>c(OH-)>c(H+)?③2.65
本题解析:略
本题难度:一般
2、推断题 下图是几种中学常见的物质之间的转化关系,氧化物A是光导纤维的主要原料,Ⅰ、Ⅲ为非金属单质、Ⅱ为主族元素的金属单质.
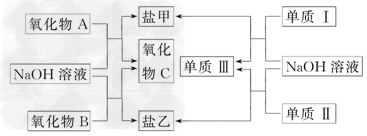
(1)氧化物A的化学式为________,写出氧化物A与NaOH溶液反应的化学方程式________________________________________;
(2)向盐乙的水溶液中通入过量CO2,发生反应的离子方程式为____________________,向乙溶液中逐渐加入氯水能看到的实验现象为____________________.
(3)单质Ⅰ的用途非常广泛,如用作________(只需写一种);工业上制备单质Ⅰ的化学方程式为_____________________________________.
参考答案:(1)SiO2;SiO2+2NaOH==Na2SiO3+H2O
(2)AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-;产生白色沉淀,然后沉淀逐渐溶解至消失
(3)半导体材料(其他合理答案也可);SiO2+2C Si+2CO↑
Si+2CO↑
本题解析:
本题难度:一般
3、填空题 (7分)下图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质。
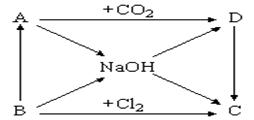
(1)写出C的化学式:________________ 。
(2)写出实现下列变化的化学方程式:
①? B → NaOH:________________________________________,
②? A → D:________________________________________ ,
(3)浓NaOH溶液能跟地壳中含量最多的金属元素的单质反应,写出该反应的离子方程式:____________________ 。
参考答案:(方程式每个2分,共7分)(1)NaCl(1分)
(2)① 2Na+2H2O===2NaOH+H2↑ ;②2Na2O2+2CO2===2Na2CO3+O2
(3)2Al+2OH—+2H2O=2AlO2—+3H2↑
本题解析:略
本题难度:一般
4、推断题 已知M是无色液体,C、H、D是有刺激性气味的气体,且D是单质,E为三原子非极性分子,②是工业上制取F的反应,J为漂白粉的有效成份。(部分反应条件未列出)
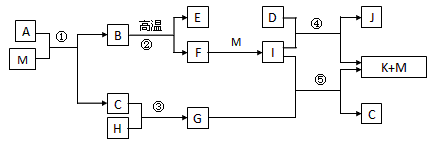
请回答下列问题:
(1)E、D、J的化学式分别是___________、___________、___________,G的电子式___________
(2)反应④的化学方程式______________________
(3)简述C的一种用途:___________
(4)A由三种元素组成,1mol A与M反应可生成1mol B和2mol C,则A的化学式是___________
(5)漂白粉常用作消毒剂、杀菌剂、漂白剂等。漂白粉是一种混合物,漂白粉质量高低由"有效氯"(过量酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)决定。漂白粉样品2.00克,加水研磨后,转入250毫升容量瓶内,用水稀释至刻度,摇匀后,取出25.0毫升,加入过量的KI溶液和过量的稀硫酸,静置。待漂白粉放出的氯气与KI完全反应后,用0.100摩/升的Na2S2O3标准溶液滴定反应中生成的碘。反应如下
2Na2S2O3+I2=Na2S4O6+2NaI滴定时用去Na2S2O3溶液20.0毫升。计算该漂白粉中有效氯的百分含量。已知漂白粉与酸的反应为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2↑+2H2O
参考答案:(1)CO2;Cl2;Ca(ClO)2; ?
?
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3)制硝酸或化肥(4)“略”
(5)“略”
本题解析:
本题难度:一般
5、推断题 已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为常见的化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的转化关系。
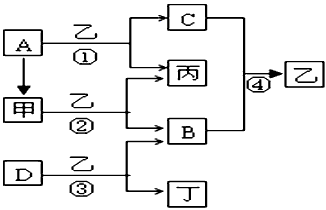
(1)写出下列物质的化学式:A__________,B__________,D__________。
(2)甲的电子式为__________,反应②中若有11.2L(标准状况下)B生成,则发生转移的电子的物质的量为__________。
(3)写出反应③的离子方程式:__________________________。
参考答案:(1)A: Na;B: O2;D: F2
(2)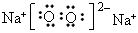 ;1mol
;1mol
(3)2F2+2H2O==4HF+O2
本题解析:
本题难度:一般