|
高中化学知识点归纳《反应速率与平衡的有关计算》高频考点强化练习(2017年最新版)(十)
2017-09-23 22:32:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
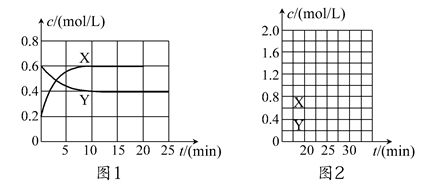
请回答:
(1)图l中,曲线________(填“X”或“Y”)表示NO2浓度随时间的变化情况;前10 min内v(NO2)=________mol/(L·min)。
(2)下列选项中不能说明该反应已达到平衡状态的是________(填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而变化
| (3)反应进行到10 min时,共吸收热量22.76 kJ,则该反应的热化学方程式为_________________________________;该反应的平衡常数K=________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为ω1,达到新平衡后混合气体中NO2的体积分数为ω2,则ω1________ω2(填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)。
参考答案:(1)X 0.04 (2)B
(3)N2O4(g)  2NO(g) ΔH=+56.9kJ/mol 0.9 2NO(g) ΔH=+56.9kJ/mol 0.9
(4)①> ②
注:每条曲线包括起点、终点、“X”和“Y”标注等。
本题解析:(1)相同时间内X与Y的浓度变化量之比为2:1,故X应表示NO2。根据v=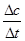 可知,v(NO2)= 可知,v(NO2)=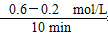 =0.04 mol/(L·min)。 =0.04 mol/(L·min)。
(2)对于反应N2O4(g)?2NO2(g),恒容条件下,压强、颜色、气体的平均相对分子质量(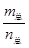 )均为变量,密度( )均为变量,密度(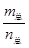 )是定值,故A、C、D均可说明该反应已达平衡,只有B不能说明。 )是定值,故A、C、D均可说明该反应已达平衡,只有B不能说明。
(3)反应进行到10 min时N2O4消耗0.4 mol,吸收22.76 kJ热量,则反应消耗1 mol N2O4时,吸收56.9 kJ热量;平衡常数K=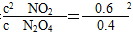 =0.9。 =0.9。
(4)平衡后再向容器内充入一定量NO2,相当于增大平衡体系的压强,促使反应N2O4(g)  2NO2(g)的平衡左移;温度不变,平衡常数不变,则0.9= 2NO2(g)的平衡左移;温度不变,平衡常数不变,则0.9= ,即达到新平衡时c(N2O4)=0.9 mol/L。第二次平衡时NO2的体积分数ω2= ,即达到新平衡时c(N2O4)=0.9 mol/L。第二次平衡时NO2的体积分数ω2=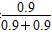 ×100%=50%;第一次平衡时NO2的体积分数ω1= ×100%=50%;第一次平衡时NO2的体积分数ω1=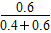 ×100%=60%。由此得出ω1>ω2。 ×100%=60%。由此得出ω1>ω2。
本题难度:一般
2、选择题 一定条件下,向容积为2L的密闭容器中充入l mol CO2和3 molH2,发生如下反应:
 ,5 min后反应达到平衡时c(CH3OH)为0.2 mol ,5 min后反应达到平衡时c(CH3OH)为0.2 mol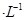 。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是 。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是
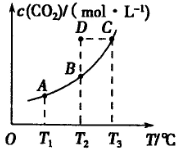
A. 0~5 min,CO2的平均反应速率为0.04 mol.(L.min)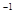
B.反应
C.在T2℃时,若反应处于状态D,则一定有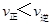
D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2
参考答案:C
本题解析:A. 5 min后反应达到平衡时c(CH3OH)为0.2 mol/L,则反应消耗的CO2浓度变化Δc(CO2)=" 0.2" mol/L。所以V(CO2)=Δc(CO2)÷Δt="0.2" mol/L÷5 min=0.04mol/(L·min).正确。B.由CO2平衡浓度与温度的关系可知:升高温度CO2浓度增大,说明升高温度排布向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以正反应是放热反应。ΔH<0. C.在T2℃时,若反应处于状态D,由于CO2浓度大于该温度的平衡浓度,所以反应向消耗CO2的方向移动。即向正反应方向移动。一定有V正>V逆。错误。D.若T1℃、T2℃时的平衡常数分别为K1、K2,由于该反应的正反应为放热反应,升高温度,平衡逆向移动,T1℃<T2℃则K1>K2。正确。
本题难度:一般
3、选择题 某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g)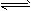 C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
[? ]
A.a=1
B.a=2
C.B的转化率为40%
D.B的转化率为20%
参考答案:AC
本题解析:
本题难度:一般
4、选择题 在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800 ℃,发生下列反应:
CO(g)+H2O(g)  CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是(?) CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是(?)
A.800 ℃下,该反应的化学平衡常数为0.25
B.427 ℃时该反应的平衡常数为9.4,则该反应的ΔH>0
C.800 ℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3%
D.800 ℃下,若继续向该平衡体系中通入1.0 mol的H2O(g) ,则平衡时CO转化率为66.7%
参考答案:D
本题解析:CO(g)+H2O(g)  CO2(g)+H2(g) CO2(g)+H2(g)
起始(mol)? 1.0?1.0?0?0
平衡(mol)? 1.0-x 1.0-x ?x?x
则1.0-x=0.5 x=0.5 mol
A项:K=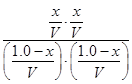 =1,错误;B项,温度降低,K增大,平衡右移,正反应为放热反应,错误;C项, =1,错误;B项,温度降低,K增大,平衡右移,正反应为放热反应,错误;C项,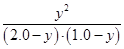 =1,y= =1,y=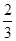 mol,CO的质量分数: mol,CO的质量分数: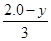 ×100%≈44.4%,错误;D项,根据C项分析,D项正确。 ×100%≈44.4%,错误;D项,根据C项分析,D项正确。
本题难度:一般
5、选择题 在恒温恒容的密闭容器里发生可逆反应: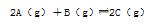 。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是 。容器内开始加入下列各组物质,达到平衡时逆反应速率最小的是
A.2molA和1molB
B.1molA和1molB
C.1molA和2molB
D.1molB和1molC
参考答案:B
本题解析:略
本题难度:一般
|