微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 某兴趣活动小组利用物质间的相互转化,设计成一个平面魔方,如下图所示

已知
①A、B、C、D、G含有同种元素.
②

③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G.
依据以上信息填空:
(1)写出D的化学式____________.
(2)G生成C的过程中所出现的现象为____________________________.
(3)写出下列反应的化学方程式:
E→A_______________________________;
A→B______________________________.
(4)B→F的离子方程式为______________________.
参考答案:(1)Fe2O3
(2)先产生白色沉淀,迅速变为灰绿色,最后变为红褐色
(3)4H2+Fe3O4 3Fe+4H2O;2Fe+3Cl2
3Fe+4H2O;2Fe+3Cl2 2FeCl3
2FeCl3
(4)2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
本题解析:
本题难度:一般
2、填空题 在下图转化关系中,已知B、D都是淡黄色固体,请回答下列问题。
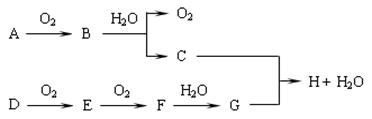
⑴写出下列物质的化学式:B?,G?。
⑵写出下列反应的化学方程式:
A→B:?;E→F:?;B→C:?。
⑶将过量气体E通入到下列各组溶液后,离子仍能大量共存的是?。?
A.Ba2+、Ca2+、Cl-?B.OH-、CO32-、Na+
C.Ca2+、ClO-、Cl-? D.H+、Fe3+、NO3-
参考答案:⑴Na2O2,H2SO4?⑵A→B:2Na+O2 Na2O2?
Na2O2?
E→F:2SO2+O2 2SO3?B→C:2Na2O2+2H2O=4NaOH+O2↑ ?⑶A
2SO3?B→C:2Na2O2+2H2O=4NaOH+O2↑ ?⑶A
本题解析:根据已知条件及相互转化关系可知:A是Na;B是Na2O2;C是NaOH;D是S;E是SO2;F是SO3;G是H2SO4.;H是Na2SO4或NaHSO4。(1)物质B的化学式是Na2O2;物质G的化学式为H2SO4。(2)A→B的化学方程式为2Na+O2 Na2O2;E→F的化学方程式为2SO2+O2
Na2O2;E→F的化学方程式为2SO2+O2 2SO3;B→C的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。(3)A. SO2的水溶液显酸性,在酸性条件下选项中的离子不会发生反应,能够电离共存。正确。B. SO2+2OH-= SO32-+H2O.不能大量共存。错误。C.发生氧化还原反应:ClO-+H2O+ SO2= SO42-+2H++Cl-.不能大量共存。错误。D.发生反应:2Fe3++2H2O+SO2= SO42-+2Fe2++4H+。故选项为A.
2SO3;B→C的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。(3)A. SO2的水溶液显酸性,在酸性条件下选项中的离子不会发生反应,能够电离共存。正确。B. SO2+2OH-= SO32-+H2O.不能大量共存。错误。C.发生氧化还原反应:ClO-+H2O+ SO2= SO42-+2H++Cl-.不能大量共存。错误。D.发生反应:2Fe3++2H2O+SO2= SO42-+2Fe2++4H+。故选项为A.
本题难度:一般
3、简答题 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.
(1)写出A、C、E物质的化学式.
A______C______E______
(2)试管壁上如果沾有A,应用______洗涤.
(3)对于C:
①将C分别通入下列溶液时有何现象,并说明产生这种现象的原因.
A.澄清石灰水:现象______
原因______
B.品红溶液:现象______
原因______
②若将C和氯气等体积混合,然后通入品红溶液,现象与①有何不同______,用化学方程式或简要文字说明不同的原因______.
(4)浓的E溶液在常温下为粘稠的液体,且E具有强吸水性、强氧化性、强脱水性.则
①E表现吸水性时,可做干燥剂,下列物质可用E干燥的是______
A.氨气B.硫化氢C.氢气D.二氧化硫
②浓E溶液与铜反应时,E除了表现强氧化性外,还表现了______性.
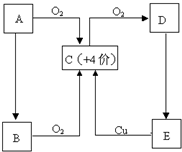
参考答案:物质A是一种淡黄色的固体,中学阶段常见有过氧化钠或硫,A能与氧气反应,则应为S,则C为SO2,由此可知D为SO3,E为H2SO4,B由A生成,与氧气反应也可生成SO2,则可知B应为H2S,
(1)由以上分析可知A为S,B为SO2,E为H2SO4,故答案为:S;SO2;H2SO4;
(2)S不溶于水,微溶于酒精,易溶于二硫化碳,可与热的氢氧化钠反应,则试管上沾有S,可用CS2或热的NaOH溶液洗涤,故答案为:CS2或热的NaOH溶液;
(3)①.A.二氧化硫可与澄清石灰水反应生成亚硫酸钙沉淀,可观察到溶液变浑浊,反应的化学方程式为SO2+Ca(OH)2=CaSO3↓+H2O,
故答案为:变浑浊;SO2+Ca(OH)2=CaSO3↓+H2O;
B.二氧化硫具有漂白性,可使品红褪色,故答案为:褪色;SO2具有漂白性;
②二氧化硫具有还原性,可与氯气发生氧化还原反应生成硫酸和盐酸,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,将二者混合通入品红中,溶液不褪色,
故答案为:品红不褪色;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)①浓硫酸具有吸水性,可用作干燥剂,但不能干燥碱性或具有强还原性气体,可干燥二氧化硫和氢气,故答案为:CD;
②浓硫酸与铜反应生成硫酸铜和二氧化硫,反应中浓硫酸表现为酸性和强氧化性,故答案为:酸.
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E、F六种物质在一定条件下的相互转化关系如图所示(所有反应物和生成物均已给出)。

(1)若反应①、②、③均为水溶液中的置换反应,且A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为___________________,其中A的化学式是___________。
(2)若B是一种能使湿润的红色石蕊试纸变蓝的气体,C是一种溶于强碱而不溶于B的水溶液的白色沉淀,图中B与E反应生成D。则气体B的空间构型为___________,反应①的离子方程式为_________________。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应②的化学方程式为
__________________
(4)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环,则化合物B的电子式为__________,用电子式表示物质A的形成过程___________,F的饱和溶液与足量E反应的离子方程式为__________________。
参考答案:
(1)E>A>D;Br2
(2)三角锥形;3NH3·H2O+Al3+ 3NH4++Al(OH)3↓
3NH4++Al(OH)3↓
(3)Fe3O4+4CO 4CO2+3Fe
4CO2+3Fe
(4)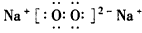 ;
;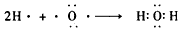 ;CO2+2Na++CO32-+H2O=2NaHCO3↓
;CO2+2Na++CO32-+H2O=2NaHCO3↓
本题解析:
本题难度:一般
5、简答题 A、B、C、D四种短周期元素的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐;B、C、D同周期,它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水,B和D可组成化合物BD.回答下列问题:
(1)A元素的气态氢化物的结构式为:______.D的最高价氧化物对应水化物的化学式:______.
(2)在工业上常用______法制备单质C(填金属的冶炼方法)
(3)C、D组成的化合物溶于水的离子方程式:______.
(4)B、C最高价氧化物对应的水化物在溶液中反应的离子方程式为:______.
参考答案:A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐,可知A是N元素(NH3+HNO3=NH4NO3);B、C、D同周期,它们的最高价氧化物对应的水化物是酸或碱,且两两之间都反应生成盐和水,可知C为Al;又B和D可组成BD化合物,可推得B为Na,D为Cl,则
(1)A为N元素,对应的气态氢化物为NH3,结构式为
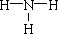
,为三角锥形,D为Cl元素,对应的最高价氧化物对应水化物为HClO4,
故答案为:

;HClO4;
(2)C为Al,为活泼金属,且对应的氧化物熔点高,难以用热还原法冶炼,工业常用电解的方法冶炼,
故答案为:电解;
(3)C、D组成的化合物为AlCl3,为强酸弱碱盐,发生Al3++3H2O?
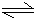
?Al(OH)3+3H+,溶液呈酸性,
故答案为:Al3++3H2O?
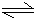
?Al(OH)3+3H+;
(4)C最高价氧化物对应的水化物为Al(OH)3,属于两性氢氧化物,与D对应的强碱NaOH反应生成,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
本题解析:
本题难度:一般