微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E、F是中学化学中常见的气体,G是一种固体非金属单质,它们具有如下的性质:
①A、B、E能使湿润的蓝色石蕊试纸变红,F能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色。
②A和F相遇产生白烟。
③B和E都能使品红溶液褪色。
④将红热的铜丝放入装有B的集气瓶中,瓶内充满棕黄色的烟。
⑤C和D相遇生成红棕色气体,且D可助燃。
⑥G是常见的半导体材料
回答下列问题:
(1)A的化学式是?,②中的白烟是?(填化学式)。
(2)④中发生反应的化学方程式是 ??
(3)C的化学式是?,E的化学式是?
(4)写出工业上制G的化学方程式??
(5)B是一种有毒气体,实验室可用?吸收B,反应的离子方程式是??
写出实验室制取B的化学方程式?
参考答案:(1)A的化学式是? HCl?,②中的白烟是? NH4Cl?(填化式)。(2)④中发生反应的化学方程式是 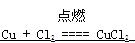 ??
??
(3)C的化学式是? NO?,E的化学式是? SO2?
?
(4)写出工业上制G的化学方程式
(5)可用? NaOH?吸收B,反应的离子方程式是Cl2+ 2 OH—=H2O+ Cl— + ClO—
写出实验室制取B的化学方程式 MnO2+4HCl===MnCl2+ Cl2+ 2H2O?
本题解析:略
本题难度:简单
2、填空题 (8分)图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。请填写以下空白:

(1)写出下列反应的化学方程式:
D+G→ H??,
F+J → B + C + I??。
(2)写出A+NaOH→D的离子方程式?。
(3)J的浓溶液久置后显黄色,其原因用化学方程式表示为_________________________。
参考答案:(8分)?
⑴ 4NH3+5O2 4NO + 6H2O? C+4HNO3
4NO + 6H2O? C+4HNO3 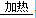 ?CO2↑+4NO2↑+2H2O
?CO2↑+4NO2↑+2H2O
⑵ NH4+ + HCO3—+2OH— = NH3 +CO32— +2H2O
⑶ 4HNO3  O2↑+4NO2↑+2H2O
O2↑+4NO2↑+2H2O
本题解析:略
本题难度:简单
3、推断题 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y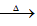 Z+W
Z+W
(1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:

a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是__________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是__________________。
③步骤c滴入稀硝酸后烧杯中的现象是________________________。反应的离子方程式是__________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
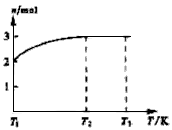
①温度在T1-T2之间,反应的化学方程式是_________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)______________。
参考答案:(1)
(2)2NH3(l)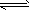 NH2-+NH4+
NH2-+NH4+
(3) ①打开止水夹,通入少量氧气;②P2O5+6OH-=2PO43-+3H2O;③Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(4) ①2NO2 N2O4;②30.7
N2O4;②30.7
本题解析:
本题难度:一般
4、选择题 无色气体X和灼热的炭反应后得另一种无色气体Y,Y和灼热的氧化铜反应后又得无色气体X.则X、Y分别是
A.O2、CO
B.CO2、CO
C.CO、CO2
D.O2、CO2
参考答案:B
本题解析:
本题难度:一般
5、填空题 某些化学反应可用下式表示:A+B→C+D+H2O
请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为?(填化学式下同)。反应的化学方程式为?。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为?。反应的化学方程式为?。
(3)若A为紫红色金属,D为有色气体。则A为?。反应的离子方程式为?。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为?。反应的离子方程式为?。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为?。反应的化学方程式为?。
参考答案:(1)Cl2;2NaOH+Cl2=NaCl+NaClO+H2O
(2)C;C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
(4)CaCO3;2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-
(5)NH3;Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
本题解析:(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为Cl2。B是氢氧化钠,则该反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,则气体应该是CO2和SO2,所以A为C,B是浓硫酸,该反应的化学方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(3)若A为紫红色金属,则A是Cu;D为有色气体,则D可能是NO2,因此该是浓硝酸与铜发生的氧化还原反应,所以该反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,则C是碳酸钙,化学式为CaCO3。D为正盐,则D为碳酸盐,B就是碳酸氢钠盐,所以该反应的离子方程式为2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,说明C溶液显碱性。实验室常用此反应制备C气体,则C为NH3。因此该反应的化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
本题难度:一般