微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图所示为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
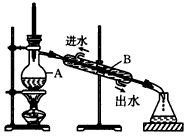
(1)图中有两处明显的错误是: ①________________, ②_______________。
(2)A仪器的名称是_________,B仪器的名称是_________。
(3)实验时A中除加入适量自来水外,还需要加入少量的__________,其作用是_______________。
参考答案:(1)①温度计水银球插入太深了;②冷却水进口、出口方向标反了
(2)蒸馏烧瓶;冷凝管
(3)沸石(或碎瓷片);防止液体暴沸
本题解析:
本题难度:一般
2、填空题 阿司匹林被誉为“百年新药”,阿司匹林药片的有效成分是乙酰立杨酸,它是一种白色晶体,微溶于水.其结构简式为:
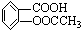
(相对分子质量为180).
已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
(1)用氢氧化钠固体配制250mL?0.10mol/L氢氧化钠溶液,完成有关填空.
a.计算所需氢氧化钠的质量;
b.向烧杯中加入适量水,搅拌、使其溶解;
c.用水洗涤烧杯、玻璃棒,洗液注入容量瓶;
d.在托盘天平上通过烧杯称量______g氢氧化钠固体;
e.盖好瓶塞,上下颠倒、摇匀;
f.冷却,将溶液移入250mL容量瓶中;
g.加水至距刻度线1-2cm处改用胶头滴管定容;
h.装瓶、贴上标签、备用
用字母表示正确的配制步骤(只填字母):______;
(2)配制250mL?0.10mol/L盐酸溶液;
(3)取阿司匹林药片于______中研碎,再称量0.3克放入锥形瓶中;滴定次数0.1mol/L盐酸读数/mL滴定前滴定后10.0017.9821.5616.5830.2215.20
(4)用碱式滴定管取25.00mL?0.10mol/L氢氧化钠溶液(过量)注入上述锥形瓶中并加热、搅拌充分反应.写出反应化学方程式:______;
(5)冷却后,在锥形瓶中加入2-3滴酚酞,用0.10mol/L盐酸滴定未反应的氢氧化钠,左手控制活塞,右手轻摇锥形瓶,眼睛______,直到溶液变为无色,在半分钟内不复原为止,记录读数.某学生取等质量阿司匹林完成实验,滴定前后的有关读数记录如图表:用有关数据计算该药片中乙酰水杨酸的质量分数为______;
| 滴定次数 | 0.1mol/L盐酸读数/mL
滴定前
滴定后
1
0.00
17.98
2
1.56
16.58
3
0.22
15.20
|
(6)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是______.
(7)下列操作可能使测定结果(质量分数)偏高的是______.
A.配制盐酸溶液时俯视刻度线定容
B.锥形瓶瓶壁残留蒸馏水
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失
D.量取氢氧化钠溶液体积时开始时仰视刻度线,结束时俯视刻度线.
参考答案:(1)m=CVM=0.10mol/L×0.25L×40g/L=1.0g;一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,然后装瓶、贴上标签、备用,所以其操作顺序是a-d-b-f-c-g-e-h,
故答案为:1.0;a-d-b-f-c-g-e-h;
(3)研磨固体药品的仪器是研钵,故答案为:研钵;
(4)乙酰水杨酸和氢氧化钠的反应方程式为:

,
故答案为:

;?
(5)酸碱中和滴定时,要根据锥形瓶内溶液的颜色变化来确定反应终点,所以眼睛要注视锥形瓶内溶液的颜色变化;
第一次滴定使用的盐酸体积=17.98mL-0.00=17.98mL,第二次滴定使用盐酸的体积=(16.58-1.56)mL=15.02mL,第三次滴定使用的盐酸体积=(15.20-0.22)mL=14.98mL,第一次使用的体积与第二次、第三次使用体积相差较大,应该舍去,应该用第二次和第三次盐酸平均值,所以盐酸体积的平均值=15.02mL+14.98mL2=15.00mL,
盐酸和氢氧化钠是按1:1的物质的量反应,所以和盐酸反应的氢氧化钠的物质的量=0.015L×0.10mol/L=0.0015mol,所以和乙酰水杨酸反应的氢氧化钠的物质的量=0.025L×0.10mol/L-0.0015mol=0.001mol.
设乙酰水杨酸的质量为x.

? 180g? 3mol
? x? 0.001mol
x=0.06g
所以其质量分数=0.06g0.3g×100%=20%,
故答案为:注视锥形瓶内溶液的颜色变化;20%;
(6)乙酸水杨酸微溶,与NaOH反应缓慢,导致不能完全反应,所以不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定,
故答案为:乙酸水杨酸微溶,与NaOH反应缓慢,导致不能完全反应;
(7)A.配制盐酸溶液时俯视刻度线定容导致盐酸的浓度偏大,使用的盐酸体积偏小,测定和盐酸反应的氢氧化钠物质的量偏小,导致和乙酰水杨酸反应的氢氧化钠的物质的量偏大,则乙酰水杨酸的质量分数偏高,故A正确;
B.锥形瓶瓶壁残留蒸馏水对氢氧化钠的物质的量无影响,所以对乙酰水杨酸的质量分数无影响,故B错误;
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失导致盐酸的体积偏小,测定和盐酸反应的氢氧化钠的物质的量偏大,所以和乙酰水杨酸反应的氢氧化钠的物质的量偏小,则乙酰水杨酸质量偏小,所以其质量分数偏小,故C错误;
D.量取氢氧化钠溶液体积时开始时仰视刻度线,结束时俯视刻度线导致量取氢氧化钠的体积偏小,导致测定和盐酸反应的氢氧化钠的物质的量偏大,所以和乙酰水杨酸反应的氢氧化钠的物质的量偏小,则乙酰水杨酸质量偏小,所以其质量分数偏小,故D错误;
故选A.
本题解析:
本题难度:简单
3、实验题 根据下面给出的药品和实验装置,设计一个实验,粗略测定由铜和锌两种金属组成的合金--黄铜中锌的质量分数(黄铜已加工成粉末)。
药品:稀硫酸、浓硫酸、氧化铜,
实验装置:另有托盘天平可用,
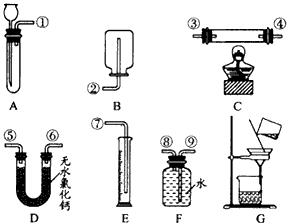
根据你设计的实验方案回答下列问题:
(1)你选用的药品是____。
(2)你选用的实验装置有___(填装置编号)。若需要组装,则连接的顺序是____(用装置接口处的编号表示。若不需要组装,则不填)。
(3)称取ag黄铜粉样品进行实验,实验中测定的 其他有效数据是___。
A.标准状况下,生成H2的体积bL
B.反应前仪器和药品的质量cg
C.反应后剩余固体的质量dg
D.反应后仪器和药品的质量eg
(4)计算合金中锌的质量分数____ 。
参考答案:(1)稀硫酸
(2)方案一:A、E、F;? 方案二:A;? 方案三:A、G ①⑧⑨⑦
(3)方案一:A;? 方案二:B、D;? 方案三:C
(4)方案一: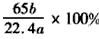 ;? 方案二:
;? 方案二: ;? 方案三:
;? 方案三: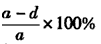
本题解析:
本题难度:一般
4、实验题 现有药品: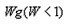 锌片、稀硫酸、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的实验,粗略测定锌的相对原子质量(假设环境为标准状况)。
锌片、稀硫酸、无水硫酸铜、氧化铜和水。请从图中选用适当的实验装置,设计一个简单的实验,粗略测定锌的相对原子质量(假设环境为标准状况)。
(1)应选用的装置是(只要求写出图中装置的标号)__________________。
(2)所用装置的连接顺序是(填各接口的字母,胶管省略)_______________。
(3)为了保证不漏出氢气,操作中加放试剂的方法是_______________。
(4)用实验所测得的数据,写出计算锌的相对原子质量的数学式:锌的相对原子质量=__________。
参考答案:(1)③④⑥
(2)G接F、E接I
(3)向试管中加入足量稀硫酸后,将试管斜放,再把锌片放在试管内壁上,塞紧塞子,慢慢直立,使锌滑下,与稀硫酸接触 (4)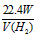
本题解析:
本题难度:一般
5、实验题 某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表
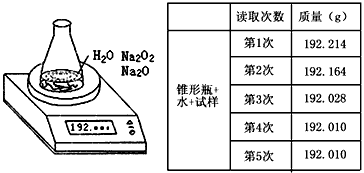
(1)写出Na2O2和H2O反应的化学方程式___________________
(2)计算过氧化钠质量分数时,必需的数据是___________________不必作第6次读数的原因是___________________
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下

①操作Ⅱ的名称是_____________
②需直接测定的物理量是____________?
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要__________(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果________(填偏大、偏小或不变)。
参考答案:(1)2Na2O2+2H2O=4NaOH+O2↑
(2)试样的质量,锥形瓶加水的质量,第四次或第五次的读数;第五次与第四次的读数相同
(3)①蒸发;②生成NaCl的质量;③玻棒、烧杯;④偏大
本题解析:
本题难度:一般