| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《化学反应速率》考点预测(2017年强化版)(八)
参考答案:B 本题解析: 本题难度:一般 3、选择题 反应A2(g) + 3B2(g) 参考答案:B 本题解析:C的物质的量浓度增加了0.3mol/5L=0.06mol/L, 本题难度:简单 4、实验题 控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
(1)本反应属于__________反应(填“吸热”或“放热”),反应的离子方程式_____________。 (2)实验6和7表明,___________对反应速率有影响,__________反应速率越快,能表明同一规律的实验还有_____________(填实验序号)。 (3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是_____________________。 (4)本实验中影响反应速率的其它因素还有________________,能表明这一规律的实验序号是1、2与____________。 参考答案:(1)放热;CaCO3+2H+===Ca2++CO2↑+H2O; 本题解析:(1)通过表中数据,对比反应前后温度变化可知,反应后溶液温度升高,则反应为放热反应,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O; 本题难度:一般 5、填空题 ( 8分 )向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
参考答案:(1) v2> v1>v3 (2)AC (3)25g (4)01.5 mol·L-1·min-1
本题解析:(1)反应速率越快,反映在曲线上,斜率就越大,所以根据图像可知反应速率从大到小的顺序为v2> v1>v3。
(2)要减小反应速率,可以通过降低盐酸的浓度、或降低反应的温度,所以答案选AC。B不影响,D是加快反应速率。
(3)最终生成CO2的体积是5.60L,物质的量是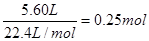 。根据碳原子守恒可知碳酸钙的物质的量也是0.25mol,质量是0.25mol×100g/mol=25g。
。根据碳原子守恒可知碳酸钙的物质的量也是0.25mol,质量是0.25mol×100g/mol=25g。
(4)EF段共收集到CO2是4.48L-1.12L=3.36L。物质的量是0.15mol,则消耗氯化氢是0.15mol×2=0.3mol,所以盐酸的反应速率是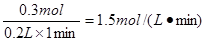 。
。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《离子共存》在线测.. | |