微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺,将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是?。
(2)下列处理SO2的方法,不合理的是_____?
A高空排放? B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵?D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有?。
A过滤? B加过量NaOH溶液? C蒸发结晶? D灼烧? E加氧化剂
II. FeCl3溶液浸取工艺其生产流程如下图所示
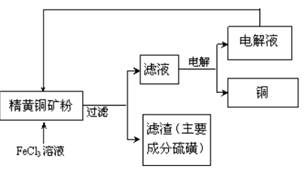
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是?(填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时,溶液中Pb2+物质的量浓度为?mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
参考答案:(1)CuFeS2、O2
(2)A、D
(3)C
(4)CuFeS2+4Fe3+=Cu2++5Fe2++2S
(5)FeCl3
(6)Fe2+-e-=Fe3+
(7)2.5×10-6
本题解析:(1)根据所给的方程式知,硫元素的化合价升高,铜元素从+2降到0价,因此CuFeS2、O2是氧化剂;
(2)SO2是大气污染物,不能随意排放,A错;用纯碱溶液吸收制备亚硫酸钠,可以防止污染,B正确;用氨水吸收,再经氧化制备硫酸铵,也可以防止污染,C正确;SO2不能溶于氯化钡溶液,D错;
(3)炉渣的主要成分是FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3,加盐酸溶解后,需要过滤出SiO2,然后再加入氧化剂将溶液中的亚铁离子氧化为三价铁离子,再加入过量的氢氧化钠溶液生成氢氧化铁沉淀,过滤、洗涤、灼烧即得到氧化铁固体。因此涉及的操作是蒸发和结晶。选C。
(4)过滤得到的滤纸中含有S,说明发生的离子方程式是CuFeS2+4Fe3+=Cu2++5Fe2++2S;
(5)电解时产生的电解液可以与黄铜矿反应,所以该工艺中可以循环的物质是FeCl3;
(6)电解池中阳极发生氧化反应,则Fe2+在阳极失去电子,所以阳极反应是,Fe2+-e-=Fe3+。
(7)已知Ksp="1" x 10一5,当溶液中c(Cl-)=2mol/L时,溶液中Pb2+的物质的量浓度是1 x 10一5/22=2.5×10-6。
本题难度:一般
2、填空题 (1)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与烧碱溶液反应。
① 若X为氧化物,X的化学式是____________。
② 若X为单质,X用于焊接钢轨反应的化学方程式是_________________________。
③ 若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。X与稀硫酸反应的离子方程式是_________________________;X与足量稀氢氧化钠溶液反应的离子方程式是_________________________。
(2)科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是_________________________。
参考答案:(1)①Al2O3;②2Al+Fe2O3 2Fe+Al2O3;③HCO3-+H+==H2O+CO2↑;NH4++HCO3-+2OH-==
2Fe+Al2O3;③HCO3-+H+==H2O+CO2↑;NH4++HCO3-+2OH-==
NH3·H2O+CO32-+H2O
(2)CO2+4H2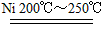 CH4+2H2O
CH4+2H2O
本题解析:
本题难度:一般
3、选择题 用稀硫酸,氢氧化钠,铝为原料制取Al(OH)3可通过不同的途径

要制得等量的Al(OH)3,三种不同的途径分别消耗硫酸的比值为
A、12:4:3?B 、3:2:1
、3:2:1
C、9:8:6?D、8:4:3
参考答案:A
本题解析:略
本题难度:一般
4、填空题 明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。

请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。
参考答案:(1)KAl(SO4)2·3H2O;(2) KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
本题解析:(1)由图像分析可知:温度升至200℃,固体质量由4.74g变为2.58g,结合KAl(SO4)2·12H2O的摩尔质量(474 g/mol)和 KAl(SO4)2的摩尔质量(258g/mol)可知:该过程为0.01molKAl(SO4)2·12H2O失去全部结晶水转化为0.01mol KAl(SO4)2的过程,则温度升至64.5℃时为明矾晶体失去部分结晶水,即固体由KAl(SO4)2·12H2O变为KAl(SO4)2·xH2O,即KAl(SO4)2·xH2O的质量为3.12g,但固体的物质的量不变仍为0.01mol,KAl(SO4)2·xH2O的摩尔质量为312 g/mol,求得x=3,化学式为KAl(SO4)2·3H2O;(2)由(1)的分析结合图像知200℃时固体由KAl(SO4)2·3H2O变为KAl(SO4)2,发生反应的化学方程式KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
本题难度:一般
5、填空题 0℃,1.01×105Pa时,分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,
反应容器
| 甲
| 乙
| 丙
| ?
|
加入合金质量(g)
| 0.510
| 1.53
| 3.57
| ?
|
与盐酸反应生成气体(L)
| 0.560
| 0.672
| 0.672
| ?
|
与氢氧化钠反应产生气体(L)
| 0.336
| x
| y
| ?
|
?
再加入不同质量的由两种金属组成的合金粉末,测量放出气体的体积。若在甲、乙、丙三个容器中加入与盐酸同体积同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积,如下表:
根据表中数据可以计算得出的是_________;
A.合金的组成? B.合金中组分的含量
C.盐酸的物质的量浓度? D.盐酸的密度
能计算出的量的值为__________________;
(2)若两种金属是下列选项中的某两种,则从甲容器中的两次实验:
①不经计算,肯定没有________________(填字母符号);
A.40Ca? B.56Fe? C.64Cu? D.24Mg? E.27Al
②通过计算讨论推测合金的成分____________;
(3)根据(2)的推测结果,计算x和y的值分别为多少?
参考答案:(1)C? 2mol/L?(2)①C?②Mg和Al?(3)x=1.008L,? y=2.016L。
本题解析:(1)由表中数据可知:甲中盐酸过量,丙中盐酸不足,则由丙中氢气的量可求出盐酸为0.06mol,进而求出盐酸的物质的量浓度为2mol/L。
(2)由题知:①中合金与盐酸、氢氧化钠溶液反应放出气体的量不等,则说明肯定没有与盐酸、氢氧化钠溶液都不反应的金属(即铜)存在;若存在铜,则另一金属与盐酸、氢氧化钠反应产生的氢气的量要么相等,要么有一个为0。
②合金中肯定有一种金属与氢氧化钠溶液反应,而另一种金属与氢氧化钠溶液不反应。能与氢氧化钠溶液反应放出氢气的只有选项中的Ca和Al。
若含有Ca:
则n(Ca)=0.015mol×40g/mol=0.600g>0.510g,所以合金中不含Ca必含Al。则m(Al)=(0.015mol×2×27g/mol)/3=0.27g,另一种金属的质量为0.51g-0.27g=0.24g,其与足量盐酸反应产生的氢气为:0.560L-0.336L=0.224L,即0.1mol。故该金属失去1mol电子时消耗的质量为12g,即Mg。
(3)由上可知:n(Mg):n(Al)=1:1,
则乙中n(Mg)=n(Al)=0.03mol,
丙中n(Mg)=n(Al)=0.07mol,
而n(NaOH)=n(HCl)=0.06mol,故乙中NaOH足量,丙中NaOH不足。由于Al~NaOH~1.5H2,所以x=0.03mol×1.5×22.4mol/L=1.008L,y=0.06mol×1.5×22.4mol/L=2.016L。
本题难度:简单