微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 多硫化钠Na2Sx(x≥2)在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16。Na2Sx在结构上与Na2O2相似。则下列有关说法正确的是
[? ]
A.该反应中Na2Sx是氧化剂,NaClO是还原剂
B.Na2Sx含有离子键和极性共价键
C.1 mol Na2Sx参加反应,有32 mol电子转移
D.Na2Sx中的x数值为2
参考答案:C
本题解析:
本题难度:一般
2、选择题 X、Y、Z、M、N代表五种金属。有如下化学反应,(1)水溶液中:X+Y2+=X2++Y? (2)Z+2H2O(冷)=Z(OH)2+H2?
(3)M、N为电极,与N的盐酸溶液组成原电池,发生的电极反应为:M-2e—=M2+
(4)Y可以溶于稀H2SO4中,M不被稀H2SO4氧化。则金属性强弱顺序正确的是(? )
A.M<N<Y<X<Z
B.N<M<X<Y<Z
C.N<M<Y<X<Z
D.X<Z<N<M<Y
参考答案:C
本题解析:(1)水溶液中:X+Y2+=X2++Y由此可知X的还原性大于Y;(3)M、N为电极,与N的盐酸溶液组成原电池,发生的电极反应为:M-2e—=M2+M的还原性大于N;(4)Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,可知Y的还原性大于M;(2)Z+2H2O(冷)=Z(OH)2+H2?,可知Z属于第一主族元素,而X、Y、M、N在水溶液中不与水反应,可知Z的还原性大于以上四种金属。综上可知,以上五种金属的金属性强弱顺序 N<M<Y<X<Z,故选C。
点评:本题考查金属的还原性,涉及相关化学反应及原电池的知识,可通过已学知识进行对比得出结果。
本题难度:简单
3、选择题 下列各组元素相互化合,既能形成离子化合物,又能形成共价化合物的是( )
A.C、H、O
B.N、Cl、H
C.K、Mg、Cl
D.Na、S、H
参考答案:D
本题解析:
本题难度:简单
4、填空题 六种短周期元素aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=
;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻.
(1)E、F形成的化合物甲的电子式为______,该化合物与A2C反应的化学方程式:______.
(2)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:______.
(3)已知B+BEC3-B2C+E2,请将方程式配平后用双线桥表示电子的转移情况______.
(4)A、E形成的四原子核化合物丙容易液化,其原因是:______.由A、C、E三种元素形成的离子化合物溶液中,离子浓度由大到小顺序为______.
(5)经检测,某固体粉末中仅含有B、C两种元素组成的化合物,请设计实验方案探究该固体粉末的成分______.
参考答案:由a+b=(c+d)2可知,a只能为第一周期元素,则a为H元素,根据a<e<c<b且A、B同主族,可知B不可能为Li,应为Na元素,设C的原子序数为x,则D的原子序数为x+8,则有
x+x+8=2×(1+11),x=8,所以C为O元素,D为S元素,C、E相邻,且e<c,则E为N元素,B、F也相邻,且b<f,则F为Mg元素,则A为氢,B为钠,C为氧,D为硫,E为氮,F为镁,
(1)E、F形成的化合物为Mg3N2,为离子化合物,电子式为
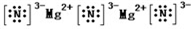
,与水发生反应生成
Mg(OH)2和NH3,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:
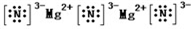
;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)H、O、Na、S对应的化合物有Na2SO4?10H2O、NaHSO4、NaHSO3等,两种化合物的水溶液相互反应的为NaHSO4和NaHSO3,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(3)反应的方程式为10Na+2NaNO3=6Na2O+N2↑,反应中10Na失去10个电子,电子转移数目为10,可表示为:
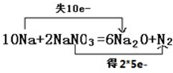
,故答案为:

;
(4)A、E形成的四原子核化合物为NH3,氨分子之间易形成氢键而导致易液化,由A、C、E三种元素形成的离子化合物为
NH4NO3,为强酸弱碱盐,NH4+水解,溶液呈酸性,则溶液中的离子浓度大小为NO3->NH4+>H+>OH-,
故答案为:氨分子之间易形成氢键;NO3->NH4+>H+>OH-;
(5)B、C两种元素组成的化合物为Na2O2、Na2O,Na2O2与水反应生成氧气,有气体生成,而Na2O与水反应没有气体生成,以此可判断是否有Na2O2,根据反应的气体的体积与反应物质量之间的关系可判断固体的成分,具体做法是将粉末加入水中,若无气体生成,则为Na2O,若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物,
故答案为:可能的组成为Na2O2,Na2O或两个都有.将粉末加入水中,若无气体生成,则为Na2O,若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物.
本题解析:
本题难度:简单
5、选择题 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物Al2H6的球棍模型如下图所示,它的熔点为150℃,燃烧热极高。下列说法肯定错误的是
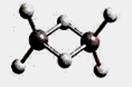
A.Al2H6在固态时所形成的晶体是分子晶体
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.氢铝化合物可能成为未来的储氢材料和火箭燃料
D.氢铝化合物中可能存在组成为的物质(n为正整数)
参考答案:D
本题解析:A、氢铝化合物由分子构成,且熔点低,故为分子晶体,正确;B、正确;C、该物质燃烧热极高,故可能成为未来的储氢材料和火箭燃料,正确;D、该类化合物符合(AlH3)n,只有n=2时符合AlnH2n+2,错误。
本题难度:一般