微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某元素的原子次外层只有两个电子,该元素一定是( )
A.第二周期
B.第ⅡA族
C.第三周期
D.第ⅦA族
2、填空题 (三选一)【选修3:物质结构与性质】
氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

(1)由B2O3制备BF3、BN的化学方程式依次是______________________________、____________________________。
(2)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3)在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
3、选择题 下列说法中错误的是
[? ]
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大,熔点高、硬度大的特性
4、填空题 【化学—选修3:物质结构与性质】(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是原子半径最小的元素
|
B元素原子的核外p电子数比s电子数少1
|
C原子的第一至第四电离能分别是:
I1=738kJ/mol? I2 =" 1451" kJ/mol? I3 = 7733kJ/mol? I4 = 10540kJ/mol
|
D原子核外所有p轨道全满或半满
|
E元素的主族序数与周期数的差为4
|
F是前四周期中电负性最小的元素
|
G在周期表的第七列
|
?
(1)已知BA5为离子化合物,写出其电子式?
(2)B基态原子中能量最高的电子,其电子云在空间有?个方向,原子轨道呈?形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,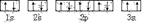
该同学所画的电子排布图违背了?
(4)G位于?族?区,价电子排布式为??
(5)DE3 中心原子的杂化方式为?,用价层电子对互斥理论推测其空间构型为?
(6)检验F元素的方法是??,请用原子结构的知识解释产生此现象的原因是?
?
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,
F原子的摩尔质量为M,则F原子的半径为??cm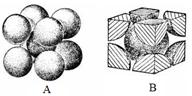
5、选择题 下列物质性质的变化规律,与共价键的键能大小有关的是
[? ]
A.F2、Cl2、Br2、I2的溶点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减小
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的溶点依次降低