微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)写出CO燃烧的热化学方程式___________________;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
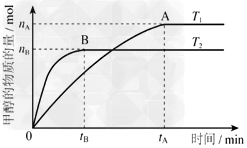
①温度升高该反应的平衡常数___________?(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是________mol·L-1·min-1
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-==CO32-+3H2O,负极的反应式为______________。
参考答案:(1)2CO(g) + O2(g) = 2CO2(g) △H=-566kJ·mol-1
(2)CH3OH(l)+ O2(g)=CO(g)+2H2O(l)?△H=-443.5kJ·mol-1
(3)减小;3n(B)/[2t(B)]?
(4)CH3OH-6e-+8OH-==CO32-+6H2O
本题解析:
本题难度:一般
2、填空题 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。 (1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g) +2H2O(g) △H = -574 kJ/mol
CH4(g) +4NO(g) = 2N2(g) +CO2(g) +2H2O(g) △H = -1160 kJ/mol
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 _______________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g) +6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
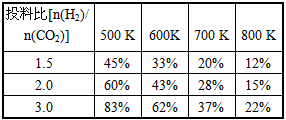
①若温度升高,则反应的平衡常数K将_________(填“增 大”“减小”或“不变”,下同);若温度不变,提高投料比[n(H2) /n(CO2)],则K将__________。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式__________________。
③在②所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12 L/min(标准状况),并以该电池作为电源电解2 mol/L CuSO4溶液500 mL,则通电30s后理论上在阴极可析出金属铜____g。
参考答案:(1)CH4(g) +2NO2(g) = N2(g) + CO2(g) + 2H2O(g) △H= -867 kJ/mol
(2)①减小;不变;②CH3OCH3- 12e- + 16OH- = 2CO32- + 11H2O;③9.6
本题解析:
本题难度:一般
3、填空题 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: ___?C+?___?KMnO4+?____?H2SO4→____CO2↑+?____MnSO4?+?____K2SO4+?____H2O?
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据
CO2(g)+H2(g),得到如下三组数据
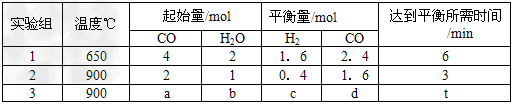
①实验1条件下平衡常数K=________(取小数二位,下同)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b?的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时
V正_____V逆(填“>”、“<”“=”)。
(3)已知在常温常压下:
①?2CH3OH(l)?+?3O2(g)?=?2CO2(g)?+?4H2O(g)?ΔH?=?-1275.6?kJ/mol
②?2CO?(g)+?O2(g)?=?2CO2(g)?ΔH?=?-566.0?kJ/mol
③?H2O(g)?=?H2O(l)?ΔH?=?-44.0?kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________
(4)为最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。该构想技术流程如下

向分解池中通入高温水蒸气的作用是_______________________________
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L?,则生成沉淀所需CaCl2溶液的最小浓度为
__________。
参考答案:(1)_5_ C+ _4_ KMnO4+ _6_ H2SO4→5_CO2↑+ 4_MnSO4 + _2_K2SO4+ _6_H2O
(2)①2.67;②<1;③<
(3)CH3OH(l)+ O2(g) =CO(g) + 2H2O(l)?△H=﹣442.8 kJ/mol?
(4)提供高温环境使KHCO3分解
(5)5.6×10-5mo1/L
本题解析:
本题难度:一般
4、简答题 )氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用.完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298K | 398K | 498K | …
K
4.1×106
K1
K2
…
|
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”).
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是______(填序号).
a.2v(H2)正=3v(NH3)逆b.v(N2)正=3v(H2)逆
c.容器内压强保持不变d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡向______方向移动.
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)______Ksp(AgBr)(填“>”“=”或“<”).
(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①298K时,1.00gN2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式______.
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式______.
参考答案:(1)①N2(g)+3H2(g)?2NH3(g)△H<0,反应为放热反应,温度升高,化学平衡向着逆向移动,氨气浓度减小,氮气、氢气浓度增大,平衡常数减小,所以K1>K2,
故答案为:>;
②a.2v正(H2)=3v逆(NH3),表示正逆反应速率相等,达到了平衡状态,故a正确;
b.v正(N2)=3v逆(H2),表示的是正反应速率和逆反应速率,但是不符合化学计量数关系,所以正逆反应速率不相等,没有达到平衡状态,故b错误;
c.容器内压强保持不变,该反应两边气体的化学计量数之和不相等,气体的物质的量是个变量,而容器容积固定,所以压强不变,说明正逆反应速率相等,达到了平衡状态,故c正确;
d.混合气体的平均摩尔质量保持不变,反应方程式两边都是气体,所以气体的质量不变,而方程式两边气体的体积不相等,所以气体的物质的量是个变量,气体的平均摩尔质量不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:acd;
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N2,此时氨气的浓度不变,所以逆反应速率不变;氮气浓度增大,平衡向着氮气浓度减小的反应一定即平衡向着正向移动,
故答案为:不变;正反应;
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,溶解度越大,溶度积越大,所以氯化银的溶度积大于溴化银的溶度积,
故答案为:>;
(2)①N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,根据化合价升降相等配平为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l),2mol肼的质量为64g,放出的热量为1225.6kJ,反应的热化学方程式为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol,
故答案为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol;
③利用肼在纯氧中燃烧生成氮气和水设计成原电池,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,负极失去电子被氧化,所以负极反应为肼失去电子被氧化成氮气,电极反应为:N2H4-4e-═N2+4H+,
故答案为:N2H4-4e-═N2+4H+.
本题解析:
本题难度:简单
5、填空题 80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:
N2O4 2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据

(1)计算20s-40s内用N2O4表示的平均反应速率为______________mol·L-1·s-1
(2)计算在80℃时该反应的平衡常数K=_______________;
(3)要增大该反应的K值,可采取的措施有(填序号)__________________;
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
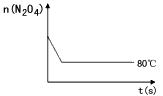
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
参考答案:(1)0.0020mol·L-1·s-1
(2)1.8mol·L-1(或1.8)
(3)D
(4)“略”
本题解析:
本题难度:一般