微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题
(1)2 s 时体系内的压强为开始时压强的多少倍?
(2)平衡体系中含N2O4的物质的量为多少?
(3)问2 s时以N2O4的浓度表示的平均反应速率是多少?
参考答案:(1)1.1(2)0.2 mol?(3)0.005 mol·L—1·S—1
本题解析:N2O4? ?2NO2
?2NO2
起始量?0.5 mol? 0
变化量? amol? 2amol
平衡量? (0.5-a)mol? 2amol
2amol/5L=0.02mol/L,则a=0.05mol,(0.5+a)/ 0.5=0.55/0.5=1.1
(2)? N2O4? ?2NO2
?2NO2
起始量?0.5 mol? 0
变化量? amol? 2amol
平衡量? (0.5-a)mol? 2amol
(0.5+a)/ 0.5="1.6?" a=0.3mol,n(N2O4)平=" (0.5-a)mol=(0.5-0.3)mol=0.2" mol
(3)2 s时以N2O4的浓度表示的平均反应速率为(0.05mol/5L)/2s="0.005" mol·L—1·S—1
本题难度:一般
2、选择题 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是
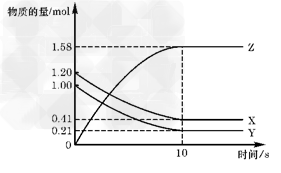
[? ]
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始时10s,X的物质的量浓度减少了0.79mol/L
C.反应开始时10s,Y的转化率为0.79(转化率=参加反应的物质的物质的量÷该物质的起始物质的量)
D.反应的化学方程式为:X(g)+Y(g) Z(g)
Z(g)
参考答案:C
本题解析:
本题难度:一般
3、选择题 在化学反应A(g)+3B(g) 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
[? ]
A.vA=vB?
B.vA=2vC?
C.2vB=3vC?
D.3vB=vD
参考答案:C
本题解析:
本题难度:简单
4、简答题 把0.6mol?X气体和0.6mol?Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min?末已生成0.2mol?W,若测知以Z的浓度变化表示的反应速率为0.1mol?L-1?min-1,请计算:
(1)2min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
(2)前2min内用X的浓度变化表示的平均反应速率.
参考答案:利用三段式法计算:
?2X(g)+Y(g)=nZ(g)+2W(g)
起始:0.6mol? 0.6mol?0? 0
转化:0.2mol? 0.1mol? 0.1nmol 0.2mol
平衡:0.4mol?0.5mol? 0.1nmol?0.2mol?
(1)平衡时Y的物质的量为0.5mol,则c(Y)=0.5mol2L=0.25mol/L,
答:2min末时Y的浓度为0.25?mol?L-1;
(2)v(W)=0.2mol2L2min=0.05mol/(L?min),c(Z)=0.1mol/(L?min),
由反应速率之比等于化学计量数之比可知:n:2=0.1mol/(L?min):0.05mol/(L?min),n=4,
答:化学反应方程式中n=4;
(3)由反应速率之比等于化学计量数之比可知:v(X)=v(W)=0.05mol/(L?min),
答:前2min内X的平均反应速率为0.05?mol?L-1?min-1.
本题解析:
本题难度:一般
5、选择题 在一定温度下,反应H2(g)+X2(g) 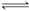 HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5%
B.17%
C.25%
D.33%
参考答案:B
本题解析:反应H2(g)+X2(g) 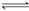 HX(g)中,HX(g)的最大分解率即达到平衡状态;
HX(g)中,HX(g)的最大分解率即达到平衡状态;
根据反应:HX(g) 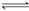 H2(g)+X2(g)
H2(g)+X2(g)
起始浓度? 1? 0? 0
变化浓度? 2x? x? x
平衡浓度 1-2x? x? x
由于反应H2(g)+X2(g)  HX(g)的平衡常数为10,则HX(g)
HX(g)的平衡常数为10,则HX(g)  H2(g)+X2(g)的平衡常数为
H2(g)+X2(g)的平衡常数为 ;所以
;所以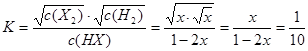 ;解得
;解得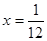 ;在该温度时HX(g)的最大分解率=
;在该温度时HX(g)的最大分解率=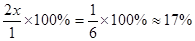
本题难度:一般