微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g) 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示:(提示:同条件体积分数=物质的量分数)
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示:(提示:同条件体积分数=物质的量分数)
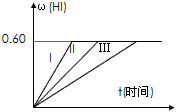
(1)达平衡时,I2(g)的物质的量浓度为________________。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是________________(填入下列条件的序号。下同),乙条件可能是
________________。
① 恒容条件下,升高温度;② 恒容条件下,降低温度;③ 恒温条件下,缩小反应容器体积;
④ 恒温条件下,扩大反应容器体积;⑤ 恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一相同的2L密闭容器中加入amol I2(g)、bmol H2和cmol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是:________________。
参考答案:(1)0.05mol·L-1
(2)③⑤;④
(3)4a+c=2b
本题解析:
本题难度:一般
2、选择题 将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应:
3A(g)+B(g) ?xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是
?xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是
A.反应速率v(B)=0.13 mol·L-1·min-1
B.该反应方程式中,x=1
C.4min时,A的物质的量为0.75mol
D.4min时,A的转化率为50%
参考答案:D
本题解析:根据题意得v(D)=0.5mol/L/4min=0.125 mol·L-1·min-1,以C表示的平均速率v(C)=0.125mol·L-1·min-1,根据化学反应速率之比等于方程式中化学计量数之比的x=2,B错误;同理可计算出v(B)=1/2v(D)=0.0625 mol·L-1·min-1,A错误;4min时,D的物质的量是0.5mol/L×2 L=1mol,所以消耗A、B的物质的量分别是1.5mol、0.5mol,设AB的起始物质的量均为ymol,则剩余A、B的物质的量分别是y-1.5mol、y-0.5mol,根据c(A):c(B)=3:5,得(y-1.5)/( y-0.5)=3:5,解得y=3mol。所以4min时,A的物质的量为3-1.5=1.5mol,C错误;A的转化率为1.5mol/3mol×100%=50%,D正确,答案选D。
本题难度:一般
3、选择题 在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  ?2C(g),下列说法中正确的是?(?)
?2C(g),下列说法中正确的是?(?)
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=
B.改变条件后,该反应的平衡常数K一定不变
C.如果改变压强并加入催化剂,平衡常数会随之变化
D.若平衡时增加A和B的浓度,则平衡常数会减小
参考答案:A
本题解析:对于在一定条件下进行的可逆反应来说,当反应达到化学平衡时,各生成物的浓度幂指数的乘积与各反应物的浓度幂指数乘积的比是个常数。这个常数就是化学平衡常数。化学平衡常数只与温度有关。而与浓度、压强等无关。根据化学平衡常数的定义可知A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K= 是正确的。B.如果改变的条件温度,则该反应的平衡常数K改变,若改变的是其它条件,则平衡常数K不变。错误。C.如果改变压强并加入催化剂,温度没变,平衡常数也不会随之变化。错误。D.若平衡时只是增加A和B的浓度,并未改变温度,平衡常数不变。错误。
是正确的。B.如果改变的条件温度,则该反应的平衡常数K改变,若改变的是其它条件,则平衡常数K不变。错误。C.如果改变压强并加入催化剂,温度没变,平衡常数也不会随之变化。错误。D.若平衡时只是增加A和B的浓度,并未改变温度,平衡常数不变。错误。
本题难度:一般
4、选择题 对于mA(g)+nB(g)  p C(g)+qD(g),图中Y轴表示平衡体系中C的百分含量(C%),下列说法中正确的是:(?)
p C(g)+qD(g),图中Y轴表示平衡体系中C的百分含量(C%),下列说法中正确的是:(?)

A.Y轴可表示混合气体平均摩尔质量
B.m+n﹥p+q
C.正反应吸热
D.Y轴可表示物质A的转化率
参考答案:CD
本题解析:由图,得:压强增大,平衡体系中C的百分含量减少,即:平衡逆向移动,所以m+n<p+q,故B错误;
混合气体的平均摩尔质量=混合气体的总质量/混合气体的总物质的量,因为A、B、C、D四者均为气体,由质量守恒,得:混合气体的总质量为一定值,因为m+n<p+q,所以,压强增大,平衡逆向移动时,混合气体的总物质的量减小,则混合气体的平均摩尔质量应增大,不符合曲线的下降趋势,故A错误;
同理,压强增大,平衡逆向移动时,物质A的转化率应减小,故D正确;
利用图中的虚线,表示在同一压强下,升温,平衡体系中C的百分含量增大,即:平衡正向移动,所以,正反应吸热,故C正确;
本题难度:一般
5、选择题 2.0 molPCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+ Cl2(g) PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是(? )
PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是(? )
A.0.40 mol
B.小于0.20 mol
C.0.20 mol
D.大于0.20 mol,小于0.40 mol
参考答案:B
本题解析:如果此时移走1.0 molPCl3和0.50 molCl2,则相当于降低压强,平衡向逆反应方向进行,因此再达平衡时 PCl5的物质的量小于0.20 mol,答案选B。
本题难度:一般